
【题目】Ag2O—Zn纽扣电池的固体拆解物中含Ag2O、Ag、Zn、Cu、石墨等物质,从中可提取金属银。如图是简要生产流程。

(1)固体拆解物需先粉碎的目的是___。
(2)浸渣的主要成分是___。
(3)以上流程中可循环使用的物质是___,除此之外,你认为通过对___(填流程图中的物质代号)的回收处理,还有可能实现___(填化学式)的循环利用。
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是___(用离子方程式表示).
(5)有人在实验室中利用如下方案回收银:

已知:Ag++2NH3![]() [Ag(NH3)2]+ K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+ K稳=1.7×107;Ksp(AgCl)=1.8×10-10
写出AgCl(s)与NH3反应的离子方程式___,该反应的平衡常数K=___。
(6)上述两种回收方案中都用到了试剂X,X是___。
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag___g(列出计算式,已知1个电子所带电量为1.6×10-19C,阿伏伽德罗常数的值用NA表示)。
【答案】增加酸浸速率,提高浸取率 石墨 Cu 滤液Ⅱ、Ⅲ Zn ![]() AgCl+2NH3
AgCl+2NH3![]() [Ag(NH3)2]++Cl- 3.06×10-3 A
[Ag(NH3)2]++Cl- 3.06×10-3 A ![]()
【解析】
(1)粉碎是为了更好的酸浸,所以目的是增大接触面积,加快酸浸速率,
故答案为:增加酸浸速率,提高浸取率;
(2)石墨不与稀硝酸反应,故滤渣为石墨,
故答案为:石墨;
(3)根据流程图知,固体混合物中含铜,回收可参与循环利用,而滤液Ⅱ、Ⅲ中均含有Zn2+,可回收加以循环利用,
故答案为:Cu;滤液Ⅱ、Ⅲ;Zn;
(4)加入Cu之前,若酸性太强,Cu与稀硝酸发生氧化还原反应,反应的离子方程式为![]() ,
,
故答案为:![]() ;
;
(5)由信息可得,AgCl溶于NH3的离子方程式为AgCl+2NH3![]() [Ag(NH3)2]++Cl-;该反应的平衡常数为
[Ag(NH3)2]++Cl-;该反应的平衡常数为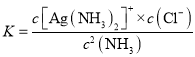 =
=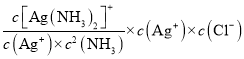 =K稳×Ksp=1.7×107×1.8×10-10=3.06×10-3,
=K稳×Ksp=1.7×107×1.8×10-10=3.06×10-3,
故答案为:AgCl+2NH3![]() [Ag(NH3)2]++Cl-;3.06×10-3;
[Ag(NH3)2]++Cl-;3.06×10-3;
(6)第一种回收方法中,固体混合物与X反应后,生成物中有铜,在固体混合物中含Zn和Cu,要回收Cu,可利用稀硫酸和CuSO4溶液,而第二种方法中,在固体混合物中含Zn和Ag,若要除去Zn,则只能利用稀硫酸,故符合题意的为A,
故答案为:A;
(7)1h=3600s,Q=It=y×3600,根据题意回收的Ag的质量=![]() g,
g,
故答案为:![]() 。
。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:![]()
![]()
![]() +H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的
+H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的![]() 浓度变化曲线未表示出):
浓度变化曲线未表示出):
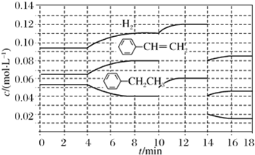
①第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________(填“<”、“>”或“=”)T(8);第10 min时反应改变的条件是_______________________________。
②比较产物苯乙烯在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小___________。
(2)页岩气的主要成分为CH4,请回答下列问题:
①已知甲烷的燃烧热为890 kJ/mol;N2与O2反应生成NO的过程如下:
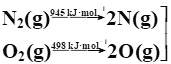
![]() 2NO(g)
2NO(g)
则CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(l) ΔH=______kJ/mol。
②页岩气可用于生产合成气(CO和H2)其反应的热化学方程式为CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=206.2 kJ/mol。对于气相反应,用各组分的平衡压强(p)表示平衡常教(记作Kp),则生产合成气的Kp=_____(写出计算的表达式),你认为可同时提高化学反应速率和CH4转化率的措施是 ______(答出一条即可)。
③在某一给定进料比的情况下,温度、压强对平衡时H2物质的量分数的影响如图所示。
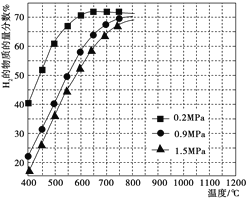
由图可知,在相同温度下,CH4的转化率随压强的增大而________(填“增大”“减小”或“不变”)。若要达到H2的物质的量分数>65%,以下条件中最合适的是_________(填序号)。
a.600℃,0.2 MPa b.600℃,0.9 MPa
c.700℃,0.9 MPa d.800℃,1.5 MPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠可用于制造陶瓷电容器的基体、颜料和催化剂。以锡锑渣(主要含Sn、Sb、As、Pb的氧化物)为原料,制备锡酸钠的工艺流程图如下图所示:

请回答下列问題:
(1)Sn(IVA)、As(VA)、Sb(VA)三种元素中,Sn的原子序数为50,其原子结构示意图为_____,碱浸”时SnO2发生反应的化学方程式为___________________________。
(2)“碱浸”时,若Sn元素氧化物中SnO含量较高,工业上则加入NaNO3,其作用是_______。
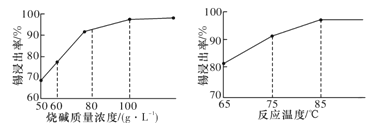
(3)从溶液中得到锡酸钠晶体的实验操作是_________、趁热过滤、洗涤、干燥。下图是“碱浸”实验的参数,请选择“碱浸”的合适条件_______。
(4)“脱铅”是从含Na2PbO2的溶液中形成硫化铅渣,其离子方程式为_________________。
(5)“脱锑”时Na2SbO4发生的化学方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g) → CH4(g)+ C2H2(g) + H2(g) △H1= +156.6 kJ/mol
②C3H6(g) → CH4(g) + C2H2(g ) △H2= +32.4 kJ/mol
则相同条件下,反应C3H8(g) → C3H6(g) + H2(g)的△H=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是KOH溶液。则燃料电池的负极反应式为_________________。
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则该溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”、“<”),原因是_____________(用离子方程式和必要的文字说明)。
(4)常温下,请写出0.1 mol/LNa2CO3溶液中的各离子浓度大小关系式:_______ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离达到平衡: H2O![]() H++ OH-ΔH > 0 ,下列叙述正确的是
H++ OH-ΔH > 0 ,下列叙述正确的是
A. 将水加热,Kw增大,pH不变
B. 向水中加入少量盐酸,c(H+)增大,Kw不变
C. 向水中加入NaOH固体,平衡逆向移动,c(OH-) 降低
D. 向水中加入AlCl3固体,平衡逆向移动,c(OH-) 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z为短周期主族元素,在周期表中的相应位置如图所示,下列说法不正确的是( )

A.若X为金属元素,则其与氧元素形成的化合物中阴阳离子个数比可能是1∶2
B.若Z、Y能形成气态氢化物,则稳定性一定是ZHn>YHn
C.若Y是金属元素,则其氢氧化物既能和强酸反应又能和强碱反应
D.三种元素的原子半径:r(X)>r(Y)>r(Z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )

A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2![]() H2+CO+O2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2 可以被NaOH溶液捕获,其基本过程如下图所示(部分条件及物质未标出)。
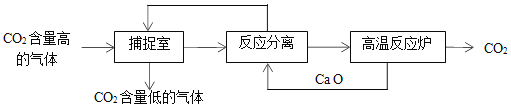
(1)下列有关该方法的叙述中正确的是______。
a.能耗大是该方法的一大缺点
b.整个过程中,只有一种物质可以循环利用
c.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
d.该方法可减少碳排放,捕捉到的 CO2还可用来制备各种化工产品
(2)若所得溶液 pH=13,CO2 主要转化为______(写离子符号)。已知 CS2与 CO2分子结构相似, CS2的电子式是______,CS2熔点高于 CO2,其原因是______。
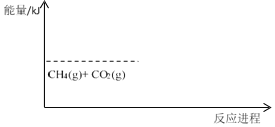
(3)CO2 与 CH4 经催化重整,制得合成气:CH4(g)+CO2(g)→2CO(g)+2H2(g)-120kJ,补全下图中 CO2 与 CH4 催化重整反应的能量变化示意图(即,注明生成物能量的大致位置及反应热效应数值)_______________
(4)常温下,在 2L 密闭容器中,下列能说明该反应达到平衡状态的是______。
a.每消耗 16gCH4 的同时生成 4gH2
b.容器中气体的压强不再改变
c.混和气体的平均相对分子质量不发生改变
d.容器中气体的密度不再改变
反应进行到 10 min 时,CO2 的质量减少了 8.8 g,则 0~10 min 内一氧化碳的反应速率是______。
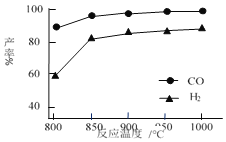
(5)按一定体积比加入 CH4 和 CO2,在恒压下发生反应,温度对 CO 和 H2 产率的影响如图所示。此反应优选温度为 900℃的原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒,其中N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )

A. 该反应的还原剂是Cl-
B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6mol电子
D. 氧化剂与还原剂的物质的量之比为2∶3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com