
����Ŀ����1����֪��![]()
![]()
![]() ��H2(g)����H����124 kJ��mol��1������Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ������(ֻ�ı�һ������)�ı仯״����ͼ��ʾ(��10 min��14 min��
��H2(g)����H����124 kJ��mol��1������Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ������(ֻ�ı�һ������)�ı仯״����ͼ��ʾ(��10 min��14 min��![]() Ũ�ȱ仯����δ��ʾ��)��
Ũ�ȱ仯����δ��ʾ��)��
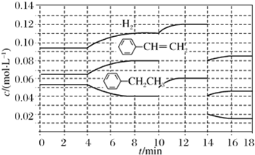
�ٵ�2 min��Ӧ�¶�T(2)���8 min��Ӧ�¶�T(8)�ĸߵͣ�T(2)________(�<������>������)T(8)����10 minʱ��Ӧ�ı��������_______________________________��
�ڱȽϲ��ﱽ��ϩ��2��3 min��5��6 min��12��13 minʱƽ����Ӧ����[ƽ����Ӧ���ʷֱ���v(2��3)��v(5��6)��v(12��13)��ʾ]�Ĵ�С___________��
��2��ҳ��������Ҫ�ɷ�ΪCH4����ش��������⣺
����֪�����ȼ����Ϊ890 kJ/mol��N2��O2��Ӧ����NO�Ĺ������£�
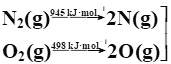
![]() 2NO(g)
2NO(g)
��CH4(g)��4NO(g)===2N2(g)��CO2(g)��2H2O(l)����H��______kJ/mol��
��ҳ���������������ϳ���(CO��H2)�䷴Ӧ���Ȼ�ѧ����ʽΪCH4(g)��H2O(g)CO(g)��3H2(g)����H��206.2 kJ/mol���������෴Ӧ���ø���ֵ�ƽ��ѹǿ(p)��ʾƽ�ⳣ��(����Kp)���������ϳ�����Kp��_____��д������ı���ʽ��������Ϊ��ͬʱ���ѧ��Ӧ���ʺ�CH4ת���ʵĴ�ʩ�� ______�����һ�����ɣ���
����ijһ�������ϱȵ�����£��¶ȡ�ѹǿ��ƽ��ʱH2���ʵ���������Ӱ����ͼ��ʾ��
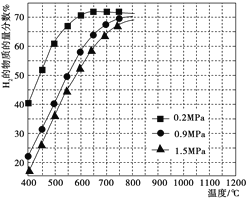
��ͼ��֪������ͬ�¶��£�CH4��ת������ѹǿ�������________(�������С�����䡱)����Ҫ�ﵽH2�����ʵ�������>65%����������������ʵ���_________(�����)��
a��600�棬0.2 MPa������������ b��600�棬0.9 MPa
c��700�棬0.9 MPa����d��800�棬1.5 MPa
���𰸡�< ��С��![]() ��Ũ�� v��5~6��> v(2~3) = v(12~13) -1256kJ/mol
��Ũ�� v��5~6��> v(2~3) = v(12~13) -1256kJ/mol 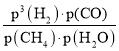 ����ˮ������Ũ�Ȼ������¶ȣ������𰸴�һ�����ɣ� ��С a
����ˮ������Ũ�Ȼ������¶ȣ������𰸴�һ�����ɣ� ��С a
��������
��1���ٸ���ͼ��仯�ƶϣ��ڸ��ݻ�ѧ��Ӧ���ʵĶ����жϣ�
��2���پ�ͼд���Ȼ�ѧ����ʽ�����ü���ȼ����д���Ȼ�ѧ����ʽ�������ø�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ�����㷴Ӧ�ȣ�
��CH4��g��+H2O��g��CO��g��+3H2��g����H=206.2kJ/mol���ø���ֵ�ƽ��ѹǿ��p����ʾƽ�ⳣ�̣�����Kp����Kp=![]() ��ͬʱ���ѧ��Ӧ���ʺ�CH4ת����������Ӧ����ƽ��������У��ݴ�ѡ��������
��ͬʱ���ѧ��Ӧ���ʺ�CH4ת����������Ӧ����ƽ��������У��ݴ�ѡ��������
��ͼ�������֪�¶Ȳ�����ѹǿ������������������С��˵������ѹǿƽ��������У���Ҫ�ﵽH2�����ʵ�������>65%��ѹǿС�¶ȵ͵���������������������
��1���ɵ�2min��Ӧ�¶ȱ�Ϊ��8min��Ӧ�¶�ʱ��������Ũ������Ӧ��Ũ�ȼ�С��ƽ��������Ӧ�����ƶ�������Ӧ�����ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ�������T(2)��T(8)����10 minʱ����ϩ��Ũ��˲ʱ��С������һ��������H2��Ũ��ȴ˲ʱ���䣬���������˵���ı������Ϊ�Ƴ����ֱ���ϩ�����С����ϩ��Ũ�ȣ���
�ʴ�Ϊ��<����С��![]() ��Ũ�ȣ�
��Ũ�ȣ�
�ڸ��ݻ�ѧ��Ӧ���ʵĶ��壬��֪��Ӧ��2��3 min��12��13 min����ƽ��״̬������ϩ��ƽ����Ӧ����Ϊ0����5��6minʱ����Ӧ������Ӧ���У��ʱ���ϩ��ƽ����Ӧ����Ϊ��v(5��6)��v(2��3)=v(12��13)��
�ʴ�Ϊ��v(5��6)��v(2��3)=v(12��13)��
��2���ٸ���ͼ���ɼ�������������Ϊ��945+498=1443 kJ/mol���ų�����Ϊ��2��630=1260kJ/mol�����Ȼ�ѧ����ʽΪ�٣� 2NO(g)=O2(g)+N2(g) ��H=(1260+1443)kJ/mol=183kJ/mol��
����ȼ����Ϊ890kJ/mol,��д���Ȼ�ѧ����ʽΪ�ڣ�CH4(g)+2O2(g)=CO2(g)+2H2O(l)����H=890kJ/mol��
�ɸ�˹���ɿ�֪��+����2���ɵ�Ŀ���Ȼ�ѧ����ʽ��CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(l) ��H=890kJ/mol+183/mol��2=1256kJmol1
�ʴ�Ϊ��1256��
��CH4(g)+H2O(g)CO(g)+3H2(g) ��H=206.2kJ/mol���ø���ֵ�ƽ��ѹǿ(p)��ʾƽ�ⳣ��(����Kp)��Kp=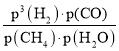 ����ӦΪ���������������ȷ�Ӧ������ˮ������Ũ�ȣ������¶ȿ�ͬʱ���ѧ��Ӧ���ʺ�CH4ת���ʣ�
����ӦΪ���������������ȷ�Ӧ������ˮ������Ũ�ȣ������¶ȿ�ͬʱ���ѧ��Ӧ���ʺ�CH4ת���ʣ�
�ʴ�Ϊ��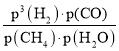 ������ˮ������Ũ�Ȼ������¶ȣ�
������ˮ������Ũ�Ȼ������¶ȣ�
����ͼ��֪������ͬ�¶��£�����������������ͬ�¶��£�ѹǿ������������������С��˵������ѹǿƽ��������У�CH4��ת������ѹǿ���������С����Ҫ�ﵽH2�����ʵ�������>65%����������������ʵ���600�棬0.2MPa����ѡa��
�ʴ�Ϊ����С�� a��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�������G�������Ʊ�����Ѫҩ����ͨ������·�ߺϳɡ�
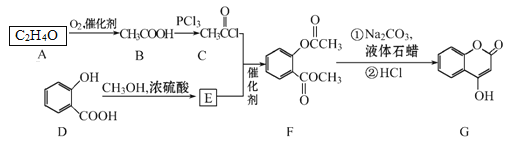
��ش�
��1��C+E��F�ķ�Ӧ������____��
��2��F�к��еĹ���������Ϊ____��
��3����A��B�ķ�Ӧ�У�����A�Ƿ�Ӧ��ȫ���Լ�Ϊ_____��
��4��д��G����NaOH��Һ����ʱ��Ӧ�Ļ�ѧ����ʽ_____��
��5��������E��ͬ���칹��ܶ࣬�������������Ľṹ��____�֡�
�������Ȼ�����Һ������ɫ�����ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ
���У��˴Ź�������Ϊ5��壬�ҷ������Ϊ2��2��2��1��1�Ľṹ��ʽΪ___��
��6��E��ͬ���칹��ܶ࣬����ͬ���칹��������ij�ֱ�����������ʾ���źţ������ݣ���ȫ��ͬ����������___�����ţ���
a�������� b����������� c��Ԫ�ط����� d���˴Ź�����
��7����֪���ǻ�һ�㲻��ֱ�������������������ᱽ������![]() ����һ����Ҫ���л��ϳ��м��塣���������֪ʶ����������Ϣ����д���Ա��ӡ��ױ�Ϊԭ����ȡ�û�����ĺϳ�·������ͼ����ԭ����ѡ����____
����һ����Ҫ���л��ϳ��м��塣���������֪ʶ����������Ϣ����д���Ա��ӡ��ױ�Ϊԭ����ȡ�û�����ĺϳ�·������ͼ����ԭ����ѡ����____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���γɻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʡ���ش��������⣺
(1)��֪CH3OH(l)��ȼ����Ϊ726.51kJ/mol��CH3OH(l) + 1/2O2(g)��CO2(g) + 2H2O(g) ��H=-a kJ/mol����a______���������������=����726.51��
(2)ʹCl2��H2O(g)ͨ�����ȵ�̿�㣬����HCl��CO2������1mol Cl2���뷴Ӧʱ�ͷų�145kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ___________________��
(3)����͵�������ı��������µ����ʡ���ʯī�����ۺͶ������Ѱ�һ����������ڸ��������գ��������ʿ������²��ϣ���Ӧ���Ȼ�ѧ����ʽΪ��4Al(s) + 3TiO2(s) + 3C(s)��2Al2O3(s) + 3TiC(s) ��H=-1176kJ/mol����Ӧ�����У�ÿת��1mol���ӷų�������Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ���е�����![]() ������Ϊ���������������������Ϊ�������ʵ���
������Ϊ���������������������Ϊ�������ʵ���![]() �����д������
����������
A. ��ʾ��
��ʾ��![]() ��
��![]() ��
��![]() ��
��![]() ����Һ�еμ�NaOH��Һ���������Ĺ�ϵ����
����Һ�еμ�NaOH��Һ���������Ĺ�ϵ����
B. ��ʾ�����ʯ��ˮ��ͨ�������ֱ̼�����������������Ĺ�ϵ����
��ʾ�����ʯ��ˮ��ͨ�������ֱ̼�����������������Ĺ�ϵ����
C. ��ʾ��NaOH��
��ʾ��NaOH��![]() �Ļ��Һ�еμ��������
�Ļ��Һ�еμ��������![]() ����Ĺ�ϵ����
����Ĺ�ϵ����
D. ��ʾ���Ȼ������Ȼ�þ��Һ�еμ�
��ʾ���Ȼ������Ȼ�þ��Һ�еμ�![]() ��Һ�����������Ĺ�ϵ����
��Һ�����������Ĺ�ϵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ H2CO3 ![]() HCO3-+H+ K1=4.3��10-7 HCO3
HCO3-+H+ K1=4.3��10-7 HCO3 ![]() CO32-+H+ K2=5.6��10-11
CO32-+H+ K2=5.6��10-11
HClO ![]() ClO-+H+ K=3.0��10-8
ClO-+H+ K=3.0��10-8
H2SO3 ![]() HSO3-+H+ K1=1.54��10-2 HSO3-
HSO3-+H+ K1=1.54��10-2 HSO3- ![]() SO32-+H+ K2=1.02��10-11
SO32-+H+ K2=1.02��10-11
���ݵ���ƽ�ⳣ�����������и�ʽ����ȷ����
A.����CO2ͨ��NaClO��Һ�У�CO2+H2O+2ClO=CO32-+2HClO
B.����SO2ͨ��Ca(ClO)2��Һ�У�SO2+H2O+Ca2++2ClO�TCaSO3��+2HClO
C.������CO2��ˮ������Ca(ClO)2��Һ��Ӧ��Ca2++2ClO+CO2+H2O�TCaCO3��+2HClO
D.��ͬŨ��NaHCO3��Һ��NaHSO3��Һ�������ϣ�H++HCO3-�TCO2��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڱ���������ȷ���ǣ� ��
A.���ķ���ʽΪC6H6��������ʹ����KMnO4��Һ��ɫ�����ڱ�����
B.�ӱ��Ŀ�����ʽ(![]() )�����������к���̼̼˫����Ӧ����ϩ��
)�����������к���̼̼˫����Ӧ����ϩ��
C.�ڴ��������£�����Һ�巴Ӧ�����屽�������˼ӳɷ�Ӧ
D.������Ϊƽ���������νṹ��6��̼ԭ��֮��ļۼ���ȫ��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������нϹ㷺�Ŀ������ã���ṹ��ʽ����ͼ��ʾ��

���ڿ������������������ȷ����(����)
A������ʽΪC16H13O9
B��1 mol����������뺬8 mol NaOH����Һ��Ӧ
C����ʹ����KMnO4��Һ��ɫ��˵�����ӽṹ�к���̼̼˫��
D����Ũ��ˮ�ܷ����������͵ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪pOH= -lgc(OH-)����T���£�ˮ��Һ��pH��pOH�Ĺ�ϵ��ͼ��ֱ����ʾ������˵����ȷ����

A.T����ˮ�����ӻ�Ϊ10-14
B.��P���Ӧ���¶�ΪT1����T1>T
C.T�棬pH=3��Һ�У���ˮ���������c(H+)һ��Ϊ1.0��10-10mol��L��1
D.T��ʱ��pH=4��������pOH=4��ˮ�������Ϻ���ҺpH>6.5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ag2O��ZnŦ�۵�صĹ��������к�Ag2O��Ag��Zn��Cu��ʯī�����ʣ����п���ȡ����������ͼ�Ǽ�Ҫ�������̡�

��1�������������ȷ����Ŀ����___��
��2����������Ҫ�ɷ���___��
��3�����������п�ѭ��ʹ�õ�������___������֮�⣬����Ϊͨ����___��������ͼ�е����ʴ��ţ��Ļ��մ��������п���ʵ��___���ѧʽ����ѭ�����á�
��4������Cu֮ǰ����Һ������̫ǿ�����ʵ�������Һ��pH��ԭ����___�������ӷ���ʽ��ʾ��.
��5��������ʵ�������������·�����������

��֪��Ag++2NH3![]() [Ag(NH3)2]+ K��=1.7��107��Ksp��AgCl��=1.8��10-10
[Ag(NH3)2]+ K��=1.7��107��Ksp��AgCl��=1.8��10-10
д��AgCl��s����NH3��Ӧ�����ӷ���ʽ___���÷�Ӧ��ƽ�ⳣ��K=___��
��6���������ֻ��շ����ж��õ����Լ�X��X��___��
A��ϡ���� B��ϡ���� C��CuSO4��Һ
��7�����ַ������յ�����Ϊ��Ʒ�����õ����ȸ��ߵ��������Ե�⾫����������ǿ��ΪyA��1Сʱ�õ�Ag___g���г�����ʽ����֪1��������������Ϊ1.6��10-19C������٤��������ֵ��NA��ʾ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com