
【题目】下列图象中的曲线![]() 纵坐标为沉淀或气体的量,横坐标为加入物质的量
纵坐标为沉淀或气体的量,横坐标为加入物质的量![]() ,其中错误的是
,其中错误的是
A. 表示向含
表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液产生沉淀的关系曲线
的溶液中滴加NaOH溶液产生沉淀的关系曲线
B. 表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
表示向澄清石灰水中通入二氧化碳直至过量产生沉淀量的关系曲线
C. 表示向NaOH和
表示向NaOH和![]() 的混合液中滴加盐酸产生
的混合液中滴加盐酸产生![]() 气体的关系曲线
气体的关系曲线
D. 表示向氯化铝和氯化镁溶液中滴加
表示向氯化铝和氯化镁溶液中滴加![]() 溶液产生沉淀量的关系曲线
溶液产生沉淀量的关系曲线
【答案】C
【解析】
A.![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中
的溶液中![]() 最易与
最易与![]() 反应,所以开始无沉淀,其次为
反应,所以开始无沉淀,其次为![]() ,反应后生成水、氢氧化铝,出现沉淀,
,反应后生成水、氢氧化铝,出现沉淀,![]() 和
和![]() 反应生成氢氧化镁,沉淀达最大量,继续滴加,
反应生成氢氧化镁,沉淀达最大量,继续滴加,![]() 和
和![]() 反应生成一水合氨,沉淀量不变,继续滴加,氢氧化铝溶解,
反应生成一水合氨,沉淀量不变,继续滴加,氢氧化铝溶解,![]() ,故A正确;
,故A正确;
B.石灰水中通入二氧化碳,先发生![]() ,生成沉淀,后发生
,生成沉淀,后发生![]() ,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,故B正确;
,故先产生沉淀,后沉淀溶解,前后两部分二氧化碳的物质的量为1:1,故B正确;
C.向NaOH和![]() 的混合液中滴加盐酸,盐酸先和氢氧化钠反应,NaOH+
的混合液中滴加盐酸,盐酸先和氢氧化钠反应,NaOH+![]() 开始没有气体,然后再与碳酸钠反应,
开始没有气体,然后再与碳酸钠反应,![]() ,
,![]() ,产生
,产生![]() 气体,开始未产生气体消耗的盐酸应比产生气体消耗的盐酸多,图象错误,故C错误;
气体,开始未产生气体消耗的盐酸应比产生气体消耗的盐酸多,图象错误,故C错误;
D.向氯化铝和氯化镁溶液中加入![]() 溶液,刚开始反生反应Mg2++2OH-=Mg(OH)2,
溶液,刚开始反生反应Mg2++2OH-=Mg(OH)2,![]() ,继续滴加,则发生
,继续滴加,则发生![]() ,故D正确;
,故D正确;
答案选C。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】已知:pAg=lgc(Ag+),Ksp(AgCl)=1×1012。如图是向10mLAgNO3溶液中逐渐加入0.1 mol·L1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]
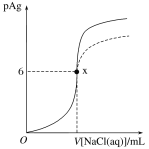
A.原AgNO3溶液的物质的量浓度为0.1mol·L1
B.图中x点的坐标为(100,6)
C.图中x点表示溶液中Ag+被恰好完全沉淀
D.把0.1 mol·L1的NaCl换成0.1mol·L1 NaI则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.装置可用于蒸干AlCl3饱和溶液制备AlCl3晶体
B.装置可测定中和反应反应热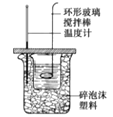
C.图丙装置可以探究温度对Na2S2O3溶液与H2SO4反应的影响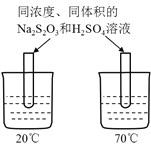
D.图丁装置可以论证醋酸、碳酸、硼酸的酸性强弱顺序为:醋酸>碳酸>硼酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S ![]() HS-+H+和HS-
HS-+H+和HS- ![]() S2-+H+,若向溶液中
S2-+H+,若向溶液中
A.加硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.通入氯气,溶液pH值增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:![]()
![]()
![]() +H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的
+H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的![]() 浓度变化曲线未表示出):
浓度变化曲线未表示出):
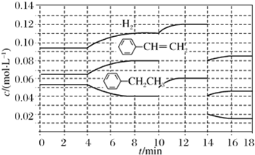
①第2 min反应温度T(2)与第8 min反应温度T(8)的高低:T(2)________(填“<”、“>”或“=”)T(8);第10 min时反应改变的条件是_______________________________。
②比较产物苯乙烯在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小___________。
(2)页岩气的主要成分为CH4,请回答下列问题:
①已知甲烷的燃烧热为890 kJ/mol;N2与O2反应生成NO的过程如下:
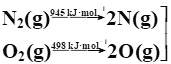
![]() 2NO(g)
2NO(g)
则CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(l) ΔH=______kJ/mol。
②页岩气可用于生产合成气(CO和H2)其反应的热化学方程式为CH4(g)+H2O(g)CO(g)+3H2(g) ΔH=206.2 kJ/mol。对于气相反应,用各组分的平衡压强(p)表示平衡常教(记作Kp),则生产合成气的Kp=_____(写出计算的表达式),你认为可同时提高化学反应速率和CH4转化率的措施是 ______(答出一条即可)。
③在某一给定进料比的情况下,温度、压强对平衡时H2物质的量分数的影响如图所示。
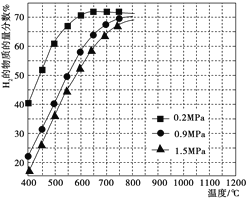
由图可知,在相同温度下,CH4的转化率随压强的增大而________(填“增大”“减小”或“不变”)。若要达到H2的物质的量分数>65%,以下条件中最合适的是_________(填序号)。
a.600℃,0.2 MPa b.600℃,0.9 MPa
c.700℃,0.9 MPa d.800℃,1.5 MPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g) → CH4(g)+ C2H2(g) + H2(g) △H1= +156.6 kJ/mol
②C3H6(g) → CH4(g) + C2H2(g ) △H2= +32.4 kJ/mol
则相同条件下,反应C3H8(g) → C3H6(g) + H2(g)的△H=________kJ/mol。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2,负极通入丙烷,电解质是KOH溶液。则燃料电池的负极反应式为_________________。
(3)常温下,0.1 mol/LNaHCO3溶液的pH大于8,则该溶液中c(H2CO3)_____c(CO32-)(填“>”、“=”、“<”),原因是_____________(用离子方程式和必要的文字说明)。
(4)常温下,请写出0.1 mol/LNa2CO3溶液中的各离子浓度大小关系式:_______ ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com