
【题目】某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒,其中N2的物质的量随时间变化的曲线如图所示,下列判断正确的是( )

A. 该反应的还原剂是Cl-
B. 反应后溶液的酸性明显增强
C. 消耗1mol还原剂,转移6mol电子
D. 氧化剂与还原剂的物质的量之比为2∶3
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】Ag2O—Zn纽扣电池的固体拆解物中含Ag2O、Ag、Zn、Cu、石墨等物质,从中可提取金属银。如图是简要生产流程。

(1)固体拆解物需先粉碎的目的是___。
(2)浸渣的主要成分是___。
(3)以上流程中可循环使用的物质是___,除此之外,你认为通过对___(填流程图中的物质代号)的回收处理,还有可能实现___(填化学式)的循环利用。
(4)加入Cu之前若溶液的酸性太强,需适当调节溶液的pH,原因是___(用离子方程式表示).
(5)有人在实验室中利用如下方案回收银:

已知:Ag++2NH3![]() [Ag(NH3)2]+ K稳=1.7×107;Ksp(AgCl)=1.8×10-10
[Ag(NH3)2]+ K稳=1.7×107;Ksp(AgCl)=1.8×10-10
写出AgCl(s)与NH3反应的离子方程式___,该反应的平衡常数K=___。
(6)上述两种回收方案中都用到了试剂X,X是___。
A.稀硫酸 B.稀硝酸 C.CuSO4溶液
(7)两种方案回收的银均为粗品,若得到纯度更高的银,可以电解精炼。若电流强度为yA,1小时后,得到Ag___g(列出计算式,已知1个电子所带电量为1.6×10-19C,阿伏伽德罗常数的值用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:在pH为4~5的环境中,Cu2+、Fe2+几乎不水解,而Fe3+几乎完全水解。用粗氧化铜(CuO中含少量Fe)制取CuCl2溶液过程如下:
①取一定量的粗CuO,加入过量浓盐酸,加热并搅拌,充分反应后过滤,溶液的pH为1。
②向滤液中通入Cl2,搅拌。
③向②中加入适量物质A,微热,搅拌,调整溶液的pH,过滤。
④把③所得滤液浓缩。
(1)①中加热并搅拌的目的是_____________________________。
(2)②中发生反应的离子方程式是_________________________。
(3)③中的物质A可能是__________________;调整的PH范围是_______________;
过滤后滤渣的成分是__________________。
(4)③中发生反应的离子方程式是_________________________。
(5)①③中如何用pH试纸测定溶液的pH值:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙及其化合物在工业上、建筑工程上和医药上用途很大。回答下列问题
(1)基态Ca原子M能层有_____个运动状态不同的电子,Ca的第一电离能__________(填“大于”或“小于”)Ga。
(2)Mn和Ca属于同一周期,且核外最外层电子构型相同,但金属Mn的熔点沸点等都比金属Ca高,原因是____________________。
(3)氯气与熟石灰反应制漂白粉时会生成副产物Ca(ClO3)2,Ca(ClO3)2中的阴离子空间构型是__________、中心原子的杂化形式为___________。
(4)碳酸盐的热分解示意图如图所示

热分解温度:CaCO3_______ (填“高于”或“低于”)SrCO3,原因是_____________________________。从价键轨道看,CO2分子内的化学键类型有__________。
(5)萤石是唯一一种可以提炼大量氟元素的矿物,晶胞如图所示。Ca2+的配位数为__________,萤石的一个晶胞的离子数为__________,已知晶胞参数为0.545nm,阿伏加德罗常数的值为NA,则萤石的密度为__________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,a、b都是惰性电极,通电一段时间后,a极附近溶液呈红色.

(1)电源的负极是_____,B中的阳极是_____。
(2)电极质量增加的是_____,A溶液的pH_____(填“增大”“减小”或“不变”)。
(3)B装置用U形管的原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛用途。
(1)化学氧化法生产高铁酸钾(K2FeO4)是用固体Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸钾和KNO2等产物。此反应中氧化剂与还原剂的物质的量之比为_____________。
(2)工业上湿法制备高铁酸钾(K2FeO4)的工艺如图所示:

①反应Ⅰ的化学方程式为_________________________________________________。
②反应Ⅱ的离子方程式为_________________________________________________。
③加入饱和KOH溶液的目的是_________________________________________________。
④高铁酸钾是一种理想的水处理剂,其处理水的原理为____________________________。
⑤实验室配制Fe(NO3)3溶液,为防止出现浑浊,一般是将Fe(NO3)3固体溶于稀HNO3后再加水稀释。已知25 ℃时,Ksp[Fe(OH)3]=4×10-38,此温度下在实验室中配制100 mL 5 mol·L-1 Fe(NO3)3溶液,则至少需要________mL、4 mol·L-1 HNO3。

(3)高铁酸钠(Na2FeO4)制备可采用三室膜电解技术,装置如图所示,阳极的电极反应式为________。电解后,阴极室得到的A溶液中溶质的主要成分为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸钠(Na2FeO4)的装置如右图所示。下列说法正确的是

A.铁是阳极,电极反应为Fe-2e-+2OH-![]() Fe(OH)2
Fe(OH)2
B.电解一段时间后,镍电极附近溶液的pH减小
C.若离子交换膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42-
D.每制得1mol Na2FeO4,理论上可以产生67.2L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜单质及其化合物在很多领域有重要的用途.
I.如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和![]() 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如图所示,![]() 中所含的化学键有 ______ .
中所含的化学键有 ______ .
![]()
(2)氯化亚铜![]() 的制备过程是:向
的制备过程是:向![]() 溶液中通入一定量
溶液中通入一定量![]() ,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
,微热,反应一段时间后即生成CuCl白色沉淀.反应的离子方程式为 ______ .
II.波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.已知![]() 的部分结构可表示如下:
的部分结构可表示如下:

(1)写出铜原子价电子层的电子排布式 ______ ,与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 ______ ![]() 填元素符号
填元素符号![]() .
.
(2)请在上图中把![]() 结构中的化学键表示出来._____________
结构中的化学键表示出来._____________
(3)![]() 晶体中配位体是 ______ ,杂化轨道类型是
晶体中配位体是 ______ ,杂化轨道类型是![]() 杂化的原子是 ______ .
杂化的原子是 ______ .
(4)金属晶体Cu中原子的堆积方式如下图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如下图丙所示.
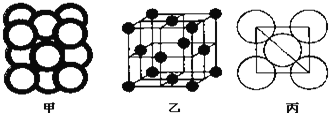
已知![]() 代表阿伏加德罗常数,Cu的相对原子质量为M,Cu单质晶体的密度为d
代表阿伏加德罗常数,Cu的相对原子质量为M,Cu单质晶体的密度为d![]() 该晶体的空间利用率是 ______ ,Cu原子半径的表达式为 ______
该晶体的空间利用率是 ______ ,Cu原子半径的表达式为 ______ ![]() 用含
用含![]() 、M、d的代数式表示
、M、d的代数式表示![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com