
����Ŀ����һ�������ȵĹ̶��ݻ����ܱ������У��������淴Ӧ��![]() ����m��n��p��qΪ��������ʱ����Ӧ�ﵽƽ��ı�־�ǣ� ��
����m��n��p��qΪ��������ʱ����Ӧ�ﵽƽ��ı�־�ǣ� ��
����ϵ��ѹǿ���ٸı� ����ϵ���¶Ȳ��ٸı� �۸���ֵ�Ũ�Ȳ��ٸı� �ܸ���������������ٸı� �ݷ�Ӧ����![]() ��λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ������ϵ���ܶȲ��ٱ仯�� ��
��λʱ����m mol A�ϼ���Ӧ��ͬʱp mol CҲ�ϼ���Ӧ������ϵ���ܶȲ��ٱ仯�� ��
A.�ۢݢ�B.�ڢۢܢ�C.�٢ۢܢ�D.�ܢޢ�
���𰸡�B
��������
����Ϊ![]() ��
��![]() �Ĺ�ϵ��ȷ�����������ڵ�ѹǿ��ʱ��ı仯��һ���DZ������ʢٲ�һ����ƽ��״̬��
�Ĺ�ϵ��ȷ�����������ڵ�ѹǿ��ʱ��ı仯��һ���DZ������ʢٲ�һ����ƽ��״̬��
���������ǡ������ȵĹ̶��ݻ����ܱ�����������Ӧ�����У���ϵ�е��¶�Ӧ��ʱ�䷢���仯�����¶Ȳ���ʱ��ƽ��״̬���ʢ���˵����Ӧ�Ѵﵽƽ��״̬��
�ܸۢ���ֵ�Ũ�Ȳ��ٸı����������������ٸı䣬��Ӧ��һ����ƽ��״̬���ʢۢ���˵����Ӧ�Ѵ�ƽ��״̬��
������֮�ȵ��ڷ���ʽ�л�ѧ������֮���Ǻ㶨�ģ����۷�Ӧ�Ƿ�ﵽƽ��״̬��������һ��ϵ���ʢݲ�һ����ƽ��״̬��
��λʱ����m mol A�ϼ���Ӧ����˵����p mol C���ɣ�ͬʱp mol CҲ�ϼ���Ӧ�����ʢ���˵����Ӧ�Ѵ�ƽ��״̬��
����ϵ���������������ʼ�ղ��䣬��ϵ���ܶ�ʼ�ղ��仯���ʢ߲���˵����Ӧ�Ѵ�ƽ��״̬��
��ѡB��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij100mL��Һ���ܺ���Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵������ȷ���ǣ�������

A. ԭ��Һһ������CO32����SO42����һ��������Fe3+
B. ԭ��Һһ������Cl�������ܴ���Na+
C. ԭ��Һ��c��Cl������0.1molL��1
D. ��ԭ��Һ�в�����Na+����c��Cl������0.1molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե��ۺ���֬Ϊԭ�ϣ��Ʊ������е�ijЩ���ʡ�
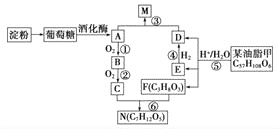
��֪����Ӧ![]() ����D��E��F�����ʵ���֮��Ϊ
����D��E��F�����ʵ���֮��Ϊ![]() ��E������ʵ�����
��E������ʵ�����![]() ��Ӧ����D����ش��������⣺
��Ӧ����D����ش��������⣺
![]() �����ǵķ���ʽΪ________��C�����й����ŵ�����Ϊ________��
�����ǵķ���ʽΪ________��C�����й����ŵ�����Ϊ________��
![]() ����˵����ȷ����________��
����˵����ȷ����________��
A.���ۡ���֬���Ǹ߷��ӻ�������ܷ���ˮ�ⷴӦ
B.C��D����ͬϵ�M��NҲ����ͬϵ��
C.����![]() ������ȡ����Ӧ��Ϊ
������ȡ����Ӧ��Ϊ![]()
D.B��E����ͬ�����ţ�������ʹ���Ը��������Һ��ɫ
![]() д��N��һ�ֽṹ��ʽ��_________________________��C��F����ͬ�ı�����Ӧ������������������������X��Y������Է�������
д��N��һ�ֽṹ��ʽ��_________________________��C��F����ͬ�ı�����Ӧ������������������������X��Y������Է�������![]() ����Y�ķ���ʽΪ________��
����Y�ķ���ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ���س������л��ϳɵ��������ʹ����ȡ��ɺ�����Һ(��Ҫ��Cr3+��Fe3+��K+��SO42-��)�Ʊ�K2Cr2O7����������ͼ��ʾ��

��֪��I �����������£�H2O2�ܽ�Cr2O72-��ԭΪCr3+
II��ؽ��������γ��������������pH��Χ���£�
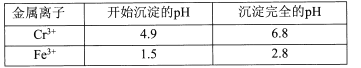
�ش��������⣺
(l)�����ڵ���Ҫ�ɷ�Ϊ____(�ѧʽ)��
(2)д���������������з�Ӧ�Ļ�ѧ����ʽ____��
(3)��������������Ŀ����____��
(4)���ữ�������з�����Ӧ2CrO42-+2H+![]() Cr2O72-+H2O (K=4��1014L3.mol3)��֪�����ữ������Һ��c(Cr2O72-)=1.6��10-3mol/L����Һ��c(CrO42-)=____
Cr2O72-+H2O (K=4��1014L3.mol3)��֪�����ữ������Һ��c(Cr2O72-)=1.6��10-3mol/L����Һ��c(CrO42-)=____
(5)���ᾧ����õ�K2Cr2O7(M=294g.mol-1)��Ʒ0.5000 g�������ܽ����ϡH2SO4�ữ������Ũ��Ϊ1.0000 mol.L-l (NH4)2Fe(SO4)2 ����Һ�ζ����ζ��յ����ı���Һ�����Ϊ9.00 mL�����Ʒ�Ĵ���Ϊ____��[�ζ���ӦΪ��K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
(6)��K2Cr2O7�����£�����������绯ѧ����ʵ�ֺ����ӷ�ˮ����Ч�������乤��ԭ������ͼ��ʾ��

�ٸ����ĵ缫��ӦʽΪ____��
��һ��ʱ����м�����NaCl��Һ��Ũ��____(����������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500��600������м��ͨ������������ˮ�Ȼ�����������ͼ��ʾ��װ�ý���ʵ�飬����˵����ȷ����

A.��Һ©����ʢ�ŵ��Լ���ϡ����
B.ϴ��ƿ��ʢ�ŵ��Լ��DZ���ʳ��ˮ
C.Ӧ�ȵ�ȼI�оƾ��ƣ��ٵ�ȼIII�оƾ���
D.�ձ���ʢ��ʯ��ˮ��Ŀ��������β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( ��
A. PH=1�Ĵ����ˮϡ�͵�ԭ�����100����ϡ�ͺ�PH=3
B. ���� pH��3�Ĵ�����Һ��pH��11��Ba(OH)2��Һ�������Ϻ���Һ������
C. ����pH��ͬ��NH4Cl��Һ��CH3COOH��Һ����ˮ���������c(H��)��ͬ
D. ij�¶��£�ˮ�����ӻ�����Ϊ1��10-12�����¶���PH=7����Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦH2��g��+I2��g��![]() 2HI��g��
2HI��g�� ![]() H<0������˵����ȷ����
H<0������˵����ȷ����
A. ��Ӧ�ﵽƽ�����С����������������ƽ����Է���������С
B. ��Ӧ�ﵽƽ����������¶Ⱥ�������䣬����HI���壬�ٴδﵽƽ�⣬H2ת���ʼ�С��ƽ�ⳣ��Kֵ��С
C. ��v����H2��=2v����HI������Ӧ�ﵽƽ��״̬
D. ��Ӧ�ﵽƽ���������������䣬���£���Ӧ��ϵ����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N2O��CO�ǻ�����Ⱦ�����壬����Pt2O+ ����ת��Ϊ�����壬�䷴Ӧԭ��ΪN2O(g) + CO(g)![]() CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
CO2(g) + N2(g) ��H���йػ�ѧ��Ӧ�����ʱ仯���̼������仯�������¡�����˵������ȷ����
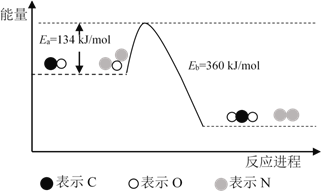
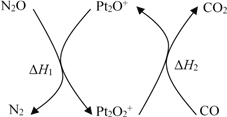
A. ��H = ��H1 + ��H2
B. ��H = 226 kJ/mol
C. �÷�Ӧ����Ӧ�Ļ��С���淴Ӧ�Ļ��
D. Ϊ��ʵ��ת���費����Ӧ���в��� Pt2O+ �� Pt2O2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��̼�����ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪25��ʱ����Ƶ�Ksp��9.1��10��6��
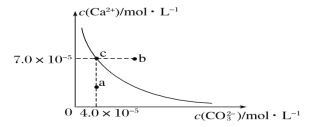
(1)ͨ����������ʹϡ��Һ��_______��仯��_______�㡣
(2)��25��ʱ����ӦCaSO4(s)��CO32- (aq)CaCO3(s)��SO42-(aq)��ƽ�ⳣ��K_______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com