
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
【答案】B
【解析】
A催化液化I的反应的△H<0、△S<0,则该反应在低温下能自发进行,故错误;
B.①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1,②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ· mol—1,根据盖斯定律,①+②可得热化学方程式为: C(s)+H2O(g)+H2(g)=CH3OH(g) ΔH=(+90.1-49.0) kJ·mol—1=+41.1 kJ·mol—1,故正确;
C.②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ· mol—1,③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g) △H3=akJ·mol—1,根据盖斯定律,②-③可得热化学方程式为:H2(g)+
O2(g) △H3=akJ·mol—1,根据盖斯定律,②-③可得热化学方程式为:H2(g)+![]() O2(g)=H2O(g) ΔH=△H2-△H3=(-49.0-a) kJ·mol—1,该反应为放热反应,即△H<0,则有△H2-△H3<0,即△H2<△H3,故错误;
O2(g)=H2O(g) ΔH=△H2-△H3=(-49.0-a) kJ·mol—1,该反应为放热反应,即△H<0,则有△H2-△H3<0,即△H2<△H3,故错误;
D.如图为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O,故错误;
故选B。


科目:高中化学 来源: 题型:
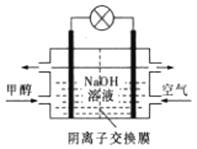
【题目】某100mL无色溶液可能含有Na+、NH4+、Mg2+、Al3+、Fe3+、CO32-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)
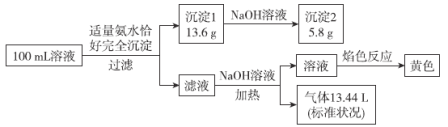
下列说法错误的是( )
A.原溶液一定存在Na+、NH4+、Mg2+、Al3+和Cl-,一定不存在Fe3+、CO32-
B.原溶液中c(NH4+)=1mol·L-1
C.沉淀2的成分为Mg(OH)2
D.原溶液中c(Cl-)≥6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为元素周期表的一部分,下列说法中正确的是( )
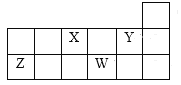
A.Z元素的最高价氧化物对应的水化物能与X的最简单气态氢化物的水溶液反应
B.X、Y、Z、W元素形成的简单离子半径由小到大的顺序为Z<X<Y<W
C.W的最简单气态氢化物的水溶液能与其最高价氧化物对应的水化物反应生成W元素对应的单质
D.X、Z两种元素的氧化物中所含化学键的类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化) ( )
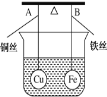
A. 杠杆为导体和绝缘体时,均为A端高B端低
B. 杠杆为导体和绝缘体时,均为A端低B端高
C. 当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低
D. 当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝铁合金投入到300 mL硝酸溶液中,金属恰好完全溶解生成Mg2+、Al3+和Fe3+;硝酸全部被还原为一氧化氮,其体积为6.72 L(标准状况),当加入300 mL某浓度氢氧化钠溶液时,金属阳离子恰好全部沉淀,干燥后测得质量为27.2 g。下列有关推断正确的是( )
A. 参加反应的硝酸的物质的量为0.9 mol
B. 参加反应的金属的质量为11.9 g
C. 硝酸的物质的量浓度为3 mol·L-1
D. 氢氧化钠的物质的量浓度为6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S粗品含有杂质,其纯化、含量测定方法如下。回答下列问题:
(1)粗品经水浸、过滤、__________________、洗涤、干燥等操作可以除去不溶性杂质,得到较纯的Na2S固体。
(2)国标中采用如图所示装置测定Na2S样品溶液中Na2CO3的百分含量(实验前,吸收管1、吸收管2、参比管中均装入组成相同的乙醇、丙酮混合溶液,该溶液吸收CO2后,颜色发生改变) 。
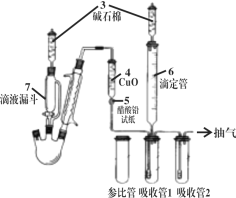
(步骤一)标定KOH标准溶液
准确称取w g邻苯二甲酸氢钾(KC8H5O4,摩尔质量为M g/mol)置于锥形瓶中,加入适量蒸馏水、2滴指示剂,用待标定的KOH溶液滴定至终点,消耗v mL KOH溶液。
①标定过程中应该选用的指示剂名称是______,理由是__________;
(已知邻苯二甲酸的电离平衡常数为Ka1=1.1×10-3,Ka2=4.0×10-6)
②KOH溶液的准确浓度为_____mol/L(用含M、v、w的代数式表示)
(步骤二)往三颈烧瓶中先后加入100mL 样品溶液、15 ml过氧化氢溶液(足量),连接好装置,加热并打开抽气装置;
(步骤三)上述反应完成后,从滴液漏斗中慢慢加入足量稀硫酸溶液,充分反应;
(步骤四)用装置6中的KOH标准溶液滴定吸收管1中的溶液至与参比管中溶液相同的颜色,3 min内不变色为终点。
③过氧化氢的作用是______;碱石棉的作用是__________;
④如果抽气速度过快,可能导致测定结果_________(填“偏高”、“偏低”或“无影响”);
⑤若步骤三中出现_______________________(填现象),说明实验失败,必须重新测定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是
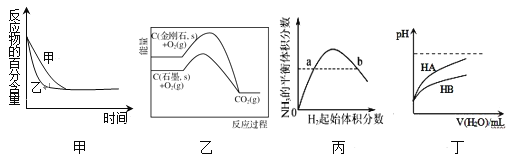
A.图甲表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
B.图乙是金刚石与石墨分别氧化生成CO2的能量关系曲线,说明石墨转化为金刚石的反应的ΔH>0
C.图丙表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率大于b点
D.图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素X、Y、Z和M在周期表中的位置如图所示。下列说法正确的是( )
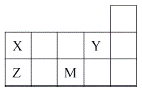
A.原子半径(r):r(X)>r(Z)
B.元素的非金属性:Y>M
C.Y元素的最高化合价为+7价
D.Z的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用甲苯合成苯甲醛:
 ,
,
下列说法正确的是
A. 甲苯分子中所有原子都在同一平面内 B. 反应①②③的反应类型相同
C. 一氯甲苯的同分异构体有3种 D. 苯甲醇可与金属钠反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com