
| A. | 在5 min内该反应用C表示的反应速率为0.02 mol•L-1•min-1 | |
| B. | 5 min时,容器内D的浓度为0.2 mol•L-1 | |
| C. | 当容器内压强保持恒定时,该可逆反应达到平衡状态 | |
| D. | 5 min时容器内气体总的物质的量为3 mol |
分析 经5min后测得容器内B的浓度减少了0.2mol•L-1,则消耗的B的物质的量为5L×0.2mol•L-1=1mol,则
A(s)+2B(g)?C(g)+2D(g)
起始:1mol 2mol 0 0
转化:0.5mol 1mol 0.5mol 1mol
平衡:0.5mol 1mol 0.5mol 1mol
以此可解答该题.
解答 解:经5min后测得容器内B的浓度减少了0.2mol•L-1,则消耗的B的物质的量为5L×0.2mol•L-1=1mol,则
A(s)+2B(g)?C(g)+2D(g)
起始:1mol 2mol 0 0
转化:0.5mol 1mol 0.5mol 1mol
平衡:0.5mol 1mol 0.5mol 1mol
A.在5min内该反应用C的浓度变化表示的反应速率为$\frac{\frac{0.5mol}{5L}}{5min}$=0.02mol•L-1•min-1,故A正确;
B.5min时,容器内D的浓度为$\frac{1mol}{5L}$=0.2mol•L-1,故B正确;
C.反应前后气体的体积不等,则当容器内压强保持恒定时,该可逆反应达到平衡状态,故C正确;
D.5min时容器内气体总的物质的量为1mol+0.5mol+1mol=2.5mol,故D错误.
故选D.
点评 本题考查化学平衡的计算,题目难度不大,注意根据三段式法计算较为直观,易错点为CD,注意A为固体的特征.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
| 序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 仪器及装置图 | 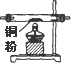 |  |  |  | 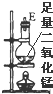 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3.4 | B. | 1:1.7 | C. | 2.6:1 | D. | 4.6:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )相同,且同时符合下列两个条件:①苯环上带有两个取代基,②有一个硝基直接连在苯环上,则符合此条件的同分异构体数目是( )
)相同,且同时符合下列两个条件:①苯环上带有两个取代基,②有一个硝基直接连在苯环上,则符合此条件的同分异构体数目是( )| A. | 3 | B. | 5 | C. | 6 | D. | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | NO2和N2O4 的混合气体中,NO2的体积分数是80% | |
| D. | 该合金中铜与镁的物质的量之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
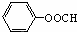 (写出结构简式).
(写出结构简式). +3NaOH→C17H35COONa+
+3NaOH→C17H35COONa+ .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
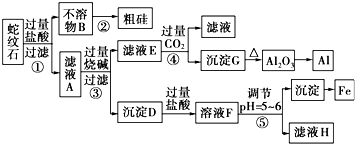
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol Cl2参加反应,转移的电子数目一定为0.2NA | |
| B. | 1.4g聚乙烯中含C-H数目为0.2NA | |
| C. | 标准状况下,5.6L甲醇中含有的分子数目为0.2NA | |
| D. | 常温下,pH=13的NaOH溶液中含OH-的数目为0.1NAA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{21n}{m-n}$ | B. | $\frac{64n}{3(m-n)}$ | C. | $\frac{m-n}{32n}$ | D. | $\frac{24n}{m-n}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com