
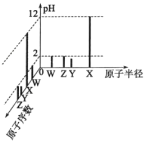
【题目】已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0.01mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )
A.化合物X2Y2中含有极性共价键和非极性共价键
B.简单气态氢化物的热稳定性:Y>W
C.简单离子半径:Z>Y>W>X
D.这四种元素中,元素X的第一电离能最小
【答案】D
【解析】
由图像和题给信息可知,浓度均为0. 01 mol.L-l的溶液,W、Y、Z的最高价氧化物对应的水化物的pH都小于7,W、Y、Z的最高价氧化物对应的水化物是酸,说明W、Y、Z都是非金属元素,W、Z最高价氧化物对应的水化物的pH=2,为一元强酸,根据原子序数Z>W,Z是N,W是Cl;Y的最高价氧化物对应的水化物的pH<2,Y的最高价氧化物对应的水化物为二元强酸,为硫酸,Y是S,X的最高价氧化物对应的水化物的pH=12,X的最高价氧化物对应的水化物为一元强碱,X是Na,可以判断出W、X、Y、Z分别为N、Na、S、Cl,由此回答。
A.化合物X2Y2为Na2S2,为离子化合物,硫原子之间为非极性共价键,S22-和Na+之间是离子键,A错误;
B.非金属性越强气态氢化物稳定性越强,氮的电负性大于硫,非金属性强,气态氢化物的稳定性W>Y,B错误;
C.电子层数越多,原子或离子的半径越大,电子层数相同时,核电荷数越大,对核外电子的吸引能力越强,半径越小,N3-、Na+、S2-、Cl-的半径大小为S2->Cl->N3->Na+,即Y>Z>W>X,C错误;
D.第一电离能数值越小,原子越容易失去一个电子,四种元素中Na最容易失去最外层电子,元素X的第一电离能最小,D正确;
答案选D。


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列关于化石燃料及其使用的一些说法中不正确的是( )
A. 煤的气化是指将固态煤粉碎后高温下变为气态,以使煤燃烧时能与氧气充分接触而完全燃烧
B. 天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
C. 石油分馏得到的汽油和石油催化裂化得到的汽油其成分不相同
D. 化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,一容积不变的密闭容器里充满硫化氢和氧气的混合气体,点燃恰好完全反应后,恢复至原状态,压强变为原来的![]() ,计算原混合气体的硫化氢和氧气的体积比________。
,计算原混合气体的硫化氢和氧气的体积比________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下:
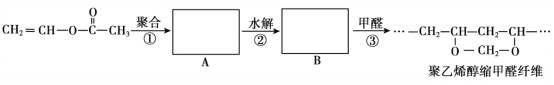
下列说法不正确的是
A.反应①是加聚反应
B.高分子A的链节中只含有一种官能团
C.通过质谱法测定高分子B的平均相对分子质量,可得其聚合度
D.反应③的化学方程式为:![]() +nHCHO→
+nHCHO→![]() +(2n-1)H2O
+(2n-1)H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员提出CeO2催化合成DMC需经历三步反应,示意图如图:
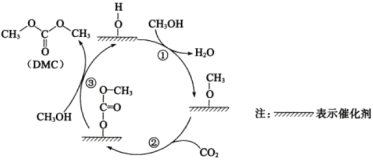
下列说法正确的是( )
A.DMC与过量NaOH溶液反应生成CO32-和甲醇
B.CeO2可有效提高反应物的平衡转化率
C.①、②、③中均有O—H的断裂
D.生成DMC总反应的原子利用率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1 mol·L-1NH4C1溶液中加入足量的镁条,该体系pH随时间变化的曲线如图所示。实验观察到b点开始溶液中有白色沉淀生成。下列说法错误的是( )(已知Ksp[Mg(OH)2]=1.8×10-11)
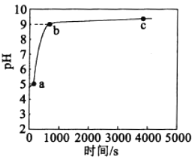
A.a点溶液中,c(NH4+)+c(H+)<c(C1-)+c(OH-)
B.b点时,溶液中c(Mg2+)=0.18 mol·L-1
C.体系中,水的电离程度大小关系为a>c>b
D.常温下,NH4C1的水解平衡常数数量级为10-10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
(1)配制100mL 0.1000mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度(mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.1000 | 30.05 | 20.00 |
2 | 0.1000 | 29.95 | 20.00 |
3 | 0.1000 | 28.20 | 20.00 |
①滴定达到终点的判断是__。
②根据上述数据,可计算出该盐酸的浓度约为___________(保留两位小数)。
③排去碱式滴定管中气泡的方法应采用操作______,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
甲.![]() 乙.
乙.![]() 丙.
丙.![]()
④在上述实验中,下列操作(其他操作正确)会造成盐酸浓度测定结果偏高的有_____。
A.碱式滴定管使用前,水洗后未用NaOH标准溶液润洗
B.锥形瓶水洗后未干燥
C.滴定前读数时正确,滴定后俯视刻度线
D.碱式滴定管尖嘴部分有气泡,滴定后消失
⑤如图是某次滴定时的滴定管中的液面,其读数为__________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com