
【题目】下列反应的产物颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种无色剧毒气体,沸点为-89.7℃,易自燃,与空气混合爆炸,微溶于水。其制取原理类似于实验室制氨气,现用下图装置来制取磷化氢并验证其性质。
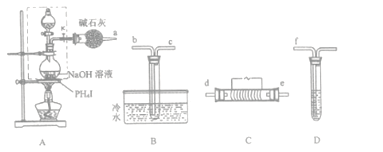
实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热。在装置C处用电热器控制温度在300℃左右,实验过程中可观察到:B装置的试管中有白色蜡状固体生成;D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,同时也有白色蜡状固体生成。请回答:
(1)按气流方向连接装置,从左到右的顺序为:
a→______→ → → →f
(2)检查A中虚线框内装置的气密性的方法是____
(3)用PH4I和烧碱反应制取PH3的化学方程式是_____________。
(4)实验开始时,先向圆底烧瓶中加入乙醚并微热数分钟,其目的是__________。
(5)装置C中反应的化学方程式是____________;装置D中反应的离子方程式是_____________。
(6)装置B、D中的现象说明PH3具有的化学性质是_________(填字母序号)。
A.碱性 B.不稳定性 C.还原性 D.酸性
(7)实验时处理尾气的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伞形酮可用作荧光指示剂和酸碱指示剂。其合成方法为
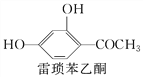

下列说法不正确的是( )
A. 雷琐苯乙酮、苹果酸和伞形酮各1 mol与足量Na反应生成H2体积之比为2∶3∶1
B. 雷琐苯乙酮和伞形酮都能跟FeCl3溶液发生显色反应
C. 1 mol雷琐苯乙酮跟足量H2反应,最多消耗4 mol H2
D. 1 mol伞形酮与足量NaOH溶液反应,最多消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl—NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜。
下列说法中正确的是

A. 通入H2—极与图乙中的铜电极相连
B. 电池工作一段时间后,溶液pH减少
C. 当消耗0.025molN2时,则铁电极增重1.6g
D. 通入N2―端的电极反应式为:N2+ 8H++ 6e-=2NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。

(1)如图中仪器①的名称是__________________。
(2)现需配制250 mL 0.200 mol·L-1NaCl溶液,如图是某同学转移溶液的示意图,装置中存在的错误是________________________
(3)下列说法中正确的是 ______________________。
A.如图中冷却水从b处流出
B.溴水中提取溴:加入萃取剂后,塞上玻璃塞,如图所示用力振摇
C.如图静置分层后,先放出下层液体,然后继续从下口放出上层液体置于另一烧杯中
D.若按如图放置温度计,会导致收集到的产品中混有低沸点的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如右图(夹持仪器略去),主要步骤如下:

步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入适量的液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MsBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是_______,它在实验中的作用是_________。
(2)步骤2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用的液溴一次性全部加入三颈瓶中,其后果是____________。
(3)步骤3中,第一次过滤得到的固体的物质是_______;根据步骤3、4,总结三乙醚合溴化镁所具有的物理性质:_________________________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-==Mg Y2-
①滴定前润洗滴定管的操作方法是_______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 molL-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25. 50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃。某小组在实验室中拟用下图所示装置制取并收集C1O2。冋答下列问题:
(1)C1O2的制备
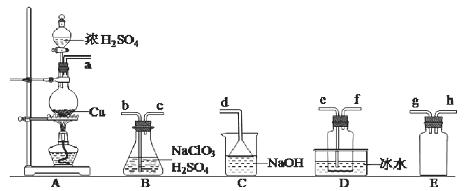
已知:SO2 +2NaClO3 +H2SO4 =2C1O2↑+2NaHSO4
①装置A中反应的化学方程式为_________________________。
②欲收集干燥的C1O2,选择上图中的装罝,其连接顺序为a→____________(按气流方向,用小写字母表示)。
③装置D的作用是_________________。
④若没有E装置,会造成的严重后果是____________________。
(2)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液.为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样;量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用c mol/LNa2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知2Na2S2O3+I2=Na2S4O6+2NaI)
①步骤2的反应中氧化产物的电子式为______。
②滴定终点的实验现象是_________________。
③原C1O2溶液的浓度为____g/L(用少骤中的字母代数式表示)。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______;若滴定开始仰视读数,滴定终点时正确读数,则测定结果_____。(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在常温下一定能大量共存的是( )
A. Na2S溶液中:SO![]() 、K+、Cl-、Cu2+
、K+、Cl-、Cu2+
B. 在c(H+)/c(OH-)=1012的溶液中:NH![]() 、NO
、NO![]() 、K+、Cl-
、K+、Cl-
C. 加入铝粉能放出H2的溶液中:Mg2+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-
D. 通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com