
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如右图(夹持仪器略去),主要步骤如下:

步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入适量的液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MsBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是_______,它在实验中的作用是_________。
(2)步骤2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用的液溴一次性全部加入三颈瓶中,其后果是____________。
(3)步骤3中,第一次过滤得到的固体的物质是_______;根据步骤3、4,总结三乙醚合溴化镁所具有的物理性质:_________________________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-==Mg Y2-
①滴定前润洗滴定管的操作方法是_______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 molL-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25. 50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
【答案】 球形冷凝管 使挥发出的乙醚和溴蒸气冷却并回流至反应装置 氮气的气流促进了液溴的挥发 反应过于剧烈,大量放热,使反应过程难以控制,因而存在安全隐患 镁屑 可溶于苯等有机溶剂,在0℃时的溶解度较小 从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次 93.8%
【解析】(1)由装置图并结合仪器的结构可知,A的名称是球形冷凝管,它在实验中的作用是使挥发出的乙醚和溴蒸气冷却并回流至反应装置;
(2) 由于氮气的气流促进了液溴的挥发,则可以将B装置中的溴完全导入三颈瓶中;将所用的液溴一次性全部加入三颈瓶中,反应过于剧烈,大量放热,使反应过程难以控制,因而存在安全隐患,故不能将液溴一次性全部加入三颈瓶中;
(3)步骤3过滤出去的是不溶于水的镁屑;根据步骤3、4,查知三乙醚合溴化镁可溶于苯等有机溶剂,在0℃时的溶解度较小;
(4)①滴定前润洗滴定管的操作方法是从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次;
②据方程式Mg2++Y4-═MgY2-分析,溴化镁的物质的量=0.0500mol/L×0.02550L=0.001275mol,则溴化镁的质量为0.001275mol×184g/mol=0.2346g,溴化镁的产品的纯度为![]() ×100%=93.8%。
×100%=93.8%。


科目:高中化学 来源: 题型:
【题目】己知乙醇与浓硫酸混合加热可发生如下反应:CH3CH2OH→CH2-CH2↑+H2O,可看作乙醇分子中脱去一分子水而生成乙烯。
(1)lmol组成为C3H8O的液态有机物A,与足量钠反应生成11.2LH2(标准状况),则A中必有一个_____基,若此基连在碳链的一端,则A的结构简式为_____________。
(2)A与浓硫酸共热也可分子内脱去一分子水而生成B,写出反应的化学方程________________。
(3)B通入溴水中可发生__________反应,该反应的方程式为:___________________。
(4)A在铜丝催化下,加热时与O2反应的化学方程式为:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。将0.2mol有机化合物A与标准状况下17.92L氧气混合点燃,两者刚好反应,只得到三种产物:CO、CO2和H2O。将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,碱石灰增重17.6克。剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,试分析:
(1)有机化合物A的分子式(要求写出推理过程)___________________
(2)若有机化合物A能与碳酸氢钠溶液反成产生气体,请写出A所有可能的的结构简式。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构和性质的描述错误的是( )
A. 光照下,异丁烷与Cl2发生取代反应生成的一氯代物有2种
B. 丙烯分子中所有原子不可能在同一平面上
C. 某烃的结构简式可表示为![]() (碳原子数≤10)。已知烃分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
(碳原子数≤10)。已知烃分子中有两种化学环境不同的氢原子,且数目之比为3∶2,则该烃一定是苯的同系物
D. 卤代烃、糖类和蛋白质均可发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在己经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种但与生产生活有密切的联
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_________________。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①合成氨的反应中的能量变化如图所示.该反应是__________反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量__________(填“大于”或“小于”)生成物化学键形成放出的总能量。
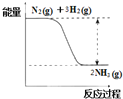
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)键性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是_________,放电时,外电路中每通过0.2mol电子,锌的质量理论上减小______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些化学仪器加热时需要放在石棉网上,但也有一些仪器可以直接在酒精灯上加热,下列各组仪器中可以用酒精灯直接加热的一组是 ( )
A. 圆底烧瓶、蒸发皿 B. 试管、烧杯 C. 试管、平底烧瓶 D. 蒸发皿、试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去有关物质中杂质的方案中,正确的是( )
选项 | 物质(括号内为杂质) | 除去杂质使用的试剂 | 除去杂质的方法 |
A | Cl2气(HCl气) | NaOH溶液,浓硫酸 | 洗气 |
B | NH4Cl溶液(FeCl3) | NaOH溶液 | 过滤 |
C | Na2CO3固体(NaHCO3) | Ba(OH)2溶液 | 过滤 |
D | I2 (H2O) | CCl4 | 萃取、分液 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com