
【题目】燃烧法是测定有机化合物分子式的一种重要方法。将0.2mol有机化合物A与标准状况下17.92L氧气混合点燃,两者刚好反应,只得到三种产物:CO、CO2和H2O。将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,碱石灰增重17.6克。剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,试分析:
(1)有机化合物A的分子式(要求写出推理过程)___________________
(2)若有机化合物A能与碳酸氢钠溶液反成产生气体,请写出A所有可能的的结构简式。____________
【答案】 C4H8O2 CH3CH2CH2COOH或(CH3)2CHCOOH
【解析】(1)标况下17.92L氧气的物质的量为:n(O2)= ![]() =0.8mol;浓硫酸增重的为水的质量,14.4gH2O的物质的量为:
=0.8mol;浓硫酸增重的为水的质量,14.4gH2O的物质的量为: ![]() =0.8mol;其中的n(H)=0.8mol×2=1.6mol,有机物燃烧生成的二氧化碳的物质的量为:
=0.8mol;其中的n(H)=0.8mol×2=1.6mol,有机物燃烧生成的二氧化碳的物质的量为: ![]() =0.4mol;剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,减少的质量为氧化铜含有的氧原子的质量,氧化铜含有的氧原子的物质的量=
=0.4mol;剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,减少的质量为氧化铜含有的氧原子的质量,氧化铜含有的氧原子的物质的量= ![]() =0.4mol,与反应生成的一氧化碳的物质的量相等,即有机物燃烧生成的一氧化碳的物质的量为0.4mol,其中的n(C)=0.4mol,有机物含氧原子的物质的量为:n(H2O)+n(CO)+2n(CO2)-2n(O2)=0.8mol+0.4mol+0.4mol×2-0.8mol×2=0.4mol,所以n(有机):n(C):n(H):n(O)=0.2:(0.4+0.4):1.6:0.4=1:4:8:2,因此化学式为C4H8O2,答:该有机物分子式为C4H8O2;
=0.4mol,与反应生成的一氧化碳的物质的量相等,即有机物燃烧生成的一氧化碳的物质的量为0.4mol,其中的n(C)=0.4mol,有机物含氧原子的物质的量为:n(H2O)+n(CO)+2n(CO2)-2n(O2)=0.8mol+0.4mol+0.4mol×2-0.8mol×2=0.4mol,所以n(有机):n(C):n(H):n(O)=0.2:(0.4+0.4):1.6:0.4=1:4:8:2,因此化学式为C4H8O2,答:该有机物分子式为C4H8O2;
(2)若有机化合物A能与碳酸氢钠反应放出气体,则分子中含有羧基,则A的结构简式为CH3 CH2 CH2COOH或(CH3)2CHCOOH,答:A所有可能的的结构简式CH3 CH2 CH2COOH或(CH3)2CHCOOH。


科目:高中化学 来源: 题型:
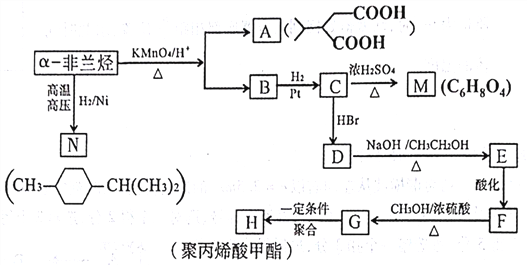
【题目】薄荷油中含有少量的a-非兰烃可以通过下列过程制得聚丙烯酸甲酯(H):
![]()
![]()
![]() +RˊCOOH
+RˊCOOH
![]()
![]() +CO2
+CO2
(1)写出a-非兰烃的结构简式___________。写出C—M的反应类型___________。
(2)下面是对于A、B、C、D的性质描述,其中正确的是___________(填标号)。
a.lmol A 可与2molNaHCO3反应放出2molCO2
b.lmolB可与2molH2发生加成反应
c.C可以发生缩聚反应
d.检验D的卤素原子种类可与NaOH水溶液共热后再加AgNO3溶液
(3)N的同分异构体中能同时满足下列两个条件的共有___________种(不含立体异构);其中核磁共振氢谱显示4组峰,且峰面积之比为4∶3∶2∶1的是___________(写结构简式)。
①含有一个六元环
②六元环上只有两个取代基,且环上每个碳原子最多只能有一个取代基
(4)E在一定条件下发生聚合反应可得到一种高级吸水树脂,写出生成该树脂反应的
化学方程式___________。
(5)写出F→G反应的化学方程式___________。
(6)BrCH2CH2CH2OH和甲醇也可以用来合成聚丙烯酸甲酯(H),写出合成路线___________(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,属于同系物的是( )
A. CH3OH、 CH3OCH3 B. 醋酸、硬脂酸 C. CH3COOH、CH3CH=CHCO0H D. HCOOCH3、CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl—NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜。
下列说法中正确的是

A. 通入H2—极与图乙中的铜电极相连
B. 电池工作一段时间后,溶液pH减少
C. 当消耗0.025molN2时,则铁电极增重1.6g
D. 通入N2―端的电极反应式为:N2+ 8H++ 6e-=2NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第IIA族元素的最外层电子数_____________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径_______。
③第二、三周期主族元素随原子序数递增原子半径的变化___________。
(2)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为______(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_______。
(3)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式_______(写一种);D的化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如右图(夹持仪器略去),主要步骤如下:

步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入适量的液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MsBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5![]() MgBr23C2H5OC2H5
MgBr23C2H5OC2H5
请回答:
(1)仪器A的名称是_______,它在实验中的作用是_________。
(2)步骤2中,可以将B装置中的溴完全导入三颈瓶中的原因是_______;该实验如果将所用的液溴一次性全部加入三颈瓶中,其后果是____________。
(3)步骤3中,第一次过滤得到的固体的物质是_______;根据步骤3、4,总结三乙醚合溴化镁所具有的物理性质:_________________________。
(4)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++Y4-==Mg Y2-
①滴定前润洗滴定管的操作方法是_______________________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 molL-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液25. 50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,工业合成氨的反应达到平衡。下列措施,既能加快该反应的速率,又能增大反应物转化率的是
A. 使用催化剂 B. 移走 NH3 C. 提高反应温度 D. 缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
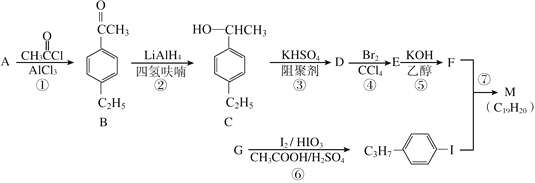
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
回答下列问题:
(1)A的结构简式为________。
(2)D分子中最多有________个碳原子共平面。
(3)①的反应类型是________,④的反应类型是________。
(4)⑤的化学方程式为____________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:___________________________________。
的合成路线:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、环境密切相关,下列有关说法错误的是
A. 夏季游泳场馆的池水可加少量漂白粉消毒 B. 用可燃冰替代燃煤作燃料可减少大气污染
C. 向海水中加入明矾可以使海水淡化 D. 石墨烯锂离子电池比镍氢电池的能量密度更高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com