
【题目】一定条件下,工业合成氨的反应达到平衡。下列措施,既能加快该反应的速率,又能增大反应物转化率的是
A. 使用催化剂 B. 移走 NH3 C. 提高反应温度 D. 缩小容器体积
科目:高中化学 来源: 题型:
【题目】以铅蓄电池为电源.将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是

A. b为铅蓄电池的正极 B. 电解过程中,阳极区溶液中c(H+)逐渐减小
C. 阴极反应式:2CO2+12H++12e-=C2H4+4H2O D. 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不合理的是
A. 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液
B. 鉴别织物成分是真丝还是人造丝:用灼烧的方法
C. 鉴定苯中无碳碳双键:加入酸性高锰酸钾溶液
D. 鉴别苯乙烯(![]() )和苯:将溴的四氯化碳溶液分别滴加到少量苯乙烯和苯中
)和苯:将溴的四氯化碳溶液分别滴加到少量苯乙烯和苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。将0.2mol有机化合物A与标准状况下17.92L氧气混合点燃,两者刚好反应,只得到三种产物:CO、CO2和H2O。将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,碱石灰增重17.6克。剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,试分析:
(1)有机化合物A的分子式(要求写出推理过程)___________________
(2)若有机化合物A能与碳酸氢钠溶液反成产生气体,请写出A所有可能的的结构简式。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计的糖厂甘蔗渣利用方案如下图所示:

其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
(1)“C6H12O6”所示的物质的名称是_________,A的电子式为_______________。
(2)写出下列转化的化学方程式并指出反应类型:
①A→B __________________________,反应类型__________________。
②C→D_________________________,反应类型__________________。
③CH3CH2OH→CH3CHO:________________,反应类型__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在己经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种但与生产生活有密切的联
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_________________。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①合成氨的反应中的能量变化如图所示.该反应是__________反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量__________(填“大于”或“小于”)生成物化学键形成放出的总能量。
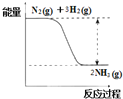
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)键性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是_________,放电时,外电路中每通过0.2mol电子,锌的质量理论上减小______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式。低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为。 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0。
反应①:2H2(g)+CO(g)![]() CH3OH(g) △H = -90.8kJ mol-1
CH3OH(g) △H = -90.8kJ mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g) △H= +41.2kJ mol-1
H2O(g)+CO(g) △H= +41.2kJ mol-1
写出用CO2与H2反应制备甲醇的热化学方程式________________________,800℃时该反应的化学平衡常数K的数值为_______________。
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如下二组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2 (g) | H2(g) | H2(g) | CO2 (g) | |||
1 | 900 | 4 | 6 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是_________。
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2 mol CO,5 mol H2O (g),则此时v正___v逆(填“>”、“>”或“=”)。
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
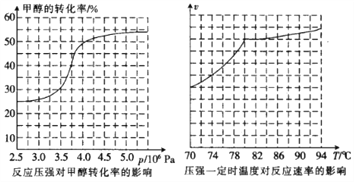
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是____(填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是______________________。
(3)已知常温下NH3H2O的电离平衡常数K= 1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2 =4. 7×10-11。常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈_____(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成-种具有果香味的物质C和化合物d的合成路线如下图所示。回答下列问题:

(1)B分子中的官能团名称为_______________。
(2)反应⑧的反应类型为_______________。
(3)反应③的化学方程式为_________________。反应⑤的化学方程式为___________________。
(4)反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是_______________。
(5)己知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D能发生酯化反应,且分子中只有两种不同化学环境的氢,则D的结构简式______________。
(6)请补充完整检验反应①淀粉水解程度的实验方案:取反应①的溶液2mL于试管中,_____________。
实验中可供选择的试剂:10%的NaOH溶液、新制Cu(OH)2悬浊液、碘水.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com