
【题目】如图甲是一种既能提供电能,又能实现氮固定的新型燃料电池(采用新型电极材料,N2、H2为电极反应物,HCl—NH4Cl为电解质溶液);图乙是利用甲装置产生的电能在铁上镀铜。
下列说法中正确的是

A. 通入H2—极与图乙中的铜电极相连
B. 电池工作一段时间后,溶液pH减少
C. 当消耗0.025molN2时,则铁电极增重1.6g
D. 通入N2―端的电极反应式为:N2+ 8H++ 6e-=2NH4+
【答案】D
【解析】A.通入H2一极的电极发生氧化反应,是原电池的负极,而电镀池是铁镀铜,则铜为阳极,应与正极相连,故A错误;B.放电过程中,负极电极反应为:H2-2e-=2H+,正极电极反应N2+8H++6e-═2NH4+,反应式为N2+3H2+2H+=2NH4+,消耗氢离子,电解质溶液PH升高,故B错误;C.当消耗0.025molN2时转移电子的物质的量为0.025mol×2×3=0.15mol,则铁电极析出铜的物质的量为![]() =0.075mol,增重0.075mol×64g/mol=4.8g,故C错误;D.通入N2一极的电极发生还原反应,电极反应式为:N2+6e-+8H+═2NH4+,故D正确;答案为D。
=0.075mol,增重0.075mol×64g/mol=4.8g,故C错误;D.通入N2一极的电极发生还原反应,电极反应式为:N2+6e-+8H+═2NH4+,故D正确;答案为D。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列不可能存在的有机物是 ( )
A. 2—甲基丙烷
B. 2,3—二氯—2,2—二甲基戊烷
C. 3—溴—3—乙基戊烷
D. 2,2,3,3—四甲基丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系正确的是
A. 密度:CCl4>CHCl3>H2O>苯
B. 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷
C. 同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷
D. 同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不合理的是
A. 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液
B. 鉴别织物成分是真丝还是人造丝:用灼烧的方法
C. 鉴定苯中无碳碳双键:加入酸性高锰酸钾溶液
D. 鉴别苯乙烯(![]() )和苯:将溴的四氯化碳溶液分别滴加到少量苯乙烯和苯中
)和苯:将溴的四氯化碳溶液分别滴加到少量苯乙烯和苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物颜色按红色、红褐色、淡黄色、蓝色顺序排列的是( )
①金属钠在纯氧中燃烧;②FeSO4溶液中滴入NaOH溶液并在空气中放置一段时间;
③FeCl3溶液中滴入KSCN溶液;④无水硫酸铜放入医用酒精中
A. ②③①④ B. ③②①④ C. ③①②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机化合物分子式的一种重要方法。将0.2mol有机化合物A与标准状况下17.92L氧气混合点燃,两者刚好反应,只得到三种产物:CO、CO2和H2O。将全部产物依次通入足量的浓硫酸和碱石灰中,浓硫酸增重14.4克,碱石灰增重17.6克。剩余气体通过足量灼热氧化铜,测得固体质量减少6.4g,试分析:
(1)有机化合物A的分子式(要求写出推理过程)___________________
(2)若有机化合物A能与碳酸氢钠溶液反成产生气体,请写出A所有可能的的结构简式。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在己经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种但与生产生活有密切的联
系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_________________。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) ![]() 2NH3(g)
2NH3(g)
①合成氨的反应中的能量变化如图所示.该反应是__________反应 (填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量__________(填“大于”或“小于”)生成物化学键形成放出的总能量。
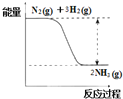
②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_____________(填序号)。
A. 容器中混合气体的密度不随时间变化 B. 断裂3molH-H键的同时断裂6molN-H键
C.N2、H2、NH3的物质的量之比为1:3:2 D.容器中的压强不随时间变化
(3)键性电池具有容量大、放电电流大的特点,固而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
则该电池的负极反应是_________,放电时,外电路中每通过0.2mol电子,锌的质量理论上减小______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X可作为合成青蒿素的一种基本原料,已知X的结构如下,下列有关X的说法正确的是
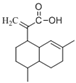 ( )
( )
A. X为烃的含氧衍生物
B. X最多可以和3mol H2发生加成反应
C. X只能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com