
【题目】将200mL CuSO4和Fe2(SO4)3的混合溶液分成两等份,向其中一份加入足量铁粉,充分反应后测得固体质量保持不变;向另一份中加入足量BaCl2溶液,经过滤、洗涤、干燥、称量,得到23.3g白色沉淀。请计算:
(1)原溶液中c(SO42-) = __________。
(2)原溶液中CuSO4和Fe2(SO4)3的物质的量比为__________。
【答案】1.00 mol/L 7:1
【解析】
(1)每一份溶液体积为100mL,由SO42-+Ba2+=BaSO4↓可知:n(SO42-)=n(BaSO4),根据c=![]() 计算硫酸根离子浓度。
计算硫酸根离子浓度。
(2)Fe+Cu2+=Fe2++Cu使固体的质量增加而2Fe3++Fe=3Fe2+使固体质量减小,固体质量保持不变,说明前者增加量等于后者减少量。
(1)根据上述每份溶液的体积为100mL,每份溶液中n(SO42-)=n(BaSO4)=![]() =0.1mol,则原溶液中c(SO42-)=
=0.1mol,则原溶液中c(SO42-)=![]() ,故答案为:1.00 mol/L。
,故答案为:1.00 mol/L。
(2)设生成Cu的质量为64g,则Fe+Cu2+=Fe2++Cu,使固体增重64g-56g=8g,则2Fe3++Fe=3Fe2+中参加反应的Fe为8g,由方程式可知,n(Cu2+)=nCu)=![]() =1mol,n(Fe3+)=2
=1mol,n(Fe3+)=2![]() =
=![]() ,故CuSO4和Fe2(SO4)2的物质的量比为1mol:(
,故CuSO4和Fe2(SO4)2的物质的量比为1mol:(![]() )=7:1,故答案为:7:1。
)=7:1,故答案为:7:1。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】酯类化合物与格氏试剂(RMgX,X=Cl、Br、I)的反应是合成叔醇类化合物的重要方法,可用于制备含氧多官能团化合物。化合物F合成路线如下,回答下列问题:
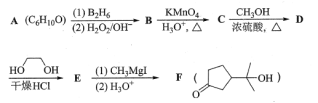
已知信息如下:
①RCH=CH2![]() RCH2CH2OH
RCH2CH2OH
②![]()
③RCOOCH3![]()
(1)A的结构简式为___,B→C的反应类型为__,C中官能团的名称为__,C→D的反应方程式为___。
(2)写出符合下列条件的D的同分异构体__(填结构简式,不考虑立体异构)。
①含有五元碳环结构;②能与NaHCO3溶液反应放出CO2;③能发生银镜反应。
(3)判断化合物F中有无手性碳原子,若有用“*”标出。__
(4)已知羟基能与格氏试剂发生反应。写出以![]() 、CH3OH和格氏试剂为原料制备
、CH3OH和格氏试剂为原料制备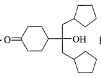 的合成路线(其它试剂任选)。__
的合成路线(其它试剂任选)。__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
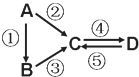
(1)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出②反应的离子方程式_______________________________________;④反应离子方程式__________________________________________________。
(2)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种黄绿色气体单质。写出A与水高温下反应的化学方程式_________________________________。④反应的离子方程式_________________________。D中加入氢氧化钠的现象_____________________。
(3)若A是太阳能电池用的光伏材料,B常用于制作高档光学器材,C、D为钠盐,C的水溶液俗称水玻璃,D的溶液显碱性。④反应也是通入一种引起温室效应的主要气体。写出③反应的化学方程式___________________________________。⑤反应用到B,反应条件为高温,则⑤的化学方程式为___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
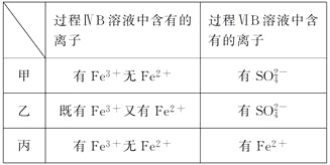
【题目】为验证氧化性:Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和A中的加热装置已略,气密性已经检验完毕)实验过程如图:
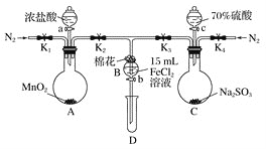
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T形导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,夹紧弹簧夹K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的阳离子。
Ⅴ.打开弹簧夹K3、活塞c,加入70%的硫酸,一段时间后夹紧弹簧夹K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程Ⅰ的目的是________________________。
(2)棉花中浸润的溶液为__________________。作用是_______________________。
(3)A中发生反应的化学方程式:______________________________________。
(4)导致步骤Ⅲ中溶液变黄的离子反应是______________________________。用______________(写试剂化学式)检验氧化产物,现象是___________________________。
(5)能说明氧化性Fe3+>SO2的离子方程式是__________________________。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果一定能够证明氧化性Cl2>Fe3+>SO2的是________________(填“甲”“乙”或“丙”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
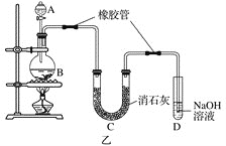
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
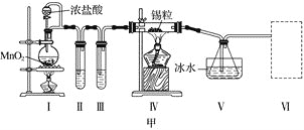
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
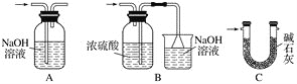
②Ⅵ处装置最好选用________(填字母)。
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根离子腐蚀,其电化学腐蚀原理如图所示,下列与此原理有关的说法中错误的是( )
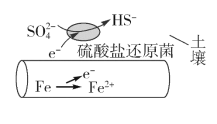
A.这种情况下,Fe腐蚀的最终产物为Fe2O3·xH2O
B.输送暖气的管道不易发生此类腐蚀
C.SO42-在正极得电子,发生还原反应
D.管道上刷富锌油漆可以延缓管道的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用来减轻感冒症状的布洛芬的结构简式如图所示,下列有关说法不正确的是( )
![]()
A.1mol布洛芬能与足量NaHCO3溶液反应最多生成1molCO2
B.布洛芬的分子式为C13H18O2
C.布洛芬苯环上的一溴代物有2种
D.布洛芬与苯甲酸甲酯是同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com