
【题目】(11分)下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ||||||
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
【答案】⑴3,ⅡA ⑵Si ⑶ ⑷离子键
⑷离子键![]()
⑸⑤⑦②③① ⑹Al(OH)3+3H+=Al3++3H2O
【解析】试题分析:⑴在编号中第⑤号元素镁的金属性最强,其位置是第三周期第IIA族;
⑵在编号中第⑦号元素硅可作为半导体材料;
⑶元素⑥为铝,其原子序数为13,其原子结构示意图为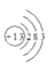 ;
;
⑷元素④为氟元素,元素⑤为镁,二者形成的化合物为MgF2,其含有离子键,其电子式为![]() ;
;
⑸根据元素①、②、③、⑤、⑦在周期表中位置关系确定其原子半径由大到小的顺序是⑤>⑦>②>③>①;
⑹元素③、⑥它们最高价氧化物的水化物分别为HNO3、Al(OH)3,二者发生的化学反应为Al(OH)3+3HNO3=Al(NO3)3+3H2O,然后将其改写为离子方程式即可。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大。A与D同主族,可形成DA型离子化合物,B与C同周期且相邻,C与E同主族,E2-与Ar原子具有相同的电子层结构,w的合金用量最大、用途最广。
回答下列问题:
(1)D在元素周期表中的位置是______________________。
(2)A分别形成与C、E形成的最简单化合物中沸点较高的是___________________(填化学式),原因是________________________。
(3)A、C、D三种元素形成的物质中含有的化学键类型是________________________。
(4)灼热的炭能与B的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为____________。
(5)向盛有A2C2溶液的试管中加入几滴酸化的WEC4溶液,溶液变成棕黄色,发生反应的离子方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 物质不是电解质就是非电解质
B. 酸性氧化物不一定都是非金属氧化物,而非金属氧化物一定是酸性氧化物
C. 能导电的物质不一定是电解质,电解质也不—定能导电
D. 液氨溶于水能导电,所用是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的叙述正确的是
A. 氟利昂-12的结构式为 ,该分子是平面型分子
,该分子是平面型分子
B. 苯与液溴混合后撤入铁粉发生了加成反应
C. 分子式为C4H9Cl的同分异构体共有4种
D. 1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016-2017学年辽宁省重点高中协作校高二上学期期中化学卷】电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%。现取20 mL pH=4的CH3COOH溶液,加入0.2 mol L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
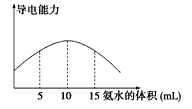
A.0.5% B.0.1% C.1.5% D.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届河南省南阳一中高三上周考五】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【陕西省榆林市2017届高考模拟第一次测试理综】常温下,各取1mL PH=2的两种二元酸H2A与H2B,分别加水稀释,PH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是
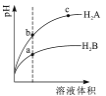
A. H2A的酸性比H2B弱
B. c点溶液的导电性比a,b点溶液的导电性都强
C. 若0.1mol/LNaHA溶液的PH=4,离子浓度大小为c(Na+)>c(HA-)>c(A2-)>c(H2A) >c(H+)>c(OH-)
D. Na2B的水溶液中,离子浓度大小为试卷c(Na+)>c(B2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0. molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示。下列有关溶液中离子浓度关系叙述正确的是( )
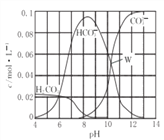
A. W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B. pH=14的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol/L
C. pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)
D. pH=11的溶液中:c(Na+)+ c(H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A. 液化石油气的主要成分 B. 含碳质量分数最大的有机物
C. 最简单的有机物 D. 1mol甲烷含有8mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com