
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g)。
Si3N4(s)+6CO(g)。
(1)该反应的平衡常数表达式为K=_________;
(2)若知上述反应为放热反应,则其反应热△H___0(填“>”、“<”或“=”);升高温度,其平衡常数值___(填“增大”、“减小”或“不变”);若已知CO生成速率为v(CO)=18molL﹣1min﹣1,则N2消耗速率为v(N2)=_____;
(3)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图.图中t4时引起平衡移动的条件可能是___;图中表示平衡混合物中CO的含量最高的一段时间是_____。

【答案】![]() < 减小 6mol/(Lmin) 升高温度或增大压强; t3﹣t4
< 减小 6mol/(Lmin) 升高温度或增大压强; t3﹣t4
【解析】
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值;
(2)该反应为放热反应,升高温度,平衡向吸热的逆反应方向移动,化学平衡常数减小;由化学反应速率之比等于化学计量数之比计算可得;
(3)该反应是一个气体体积增大的放热反应,升高温度或增大压强,正逆反应速率都增大,平衡都向逆反应方向移动。
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该反应的平衡常数表达式是K=![]() ,故答案为:
,故答案为:![]() ;
;
(2)该反应为放热反应,则反应热△H小于0;升高温度,平衡向吸热的逆反应方向移动,化学平衡常数减小;由化学反应速率之比等于化学计量数之比可知,N2消耗速率为v(N2)=![]() v(NO)=
v(NO)=![]() ×18mol·L-1·min-1=6 mol L-1min-1,故答案为:<;减小;6mol/(Lmin);
×18mol·L-1·min-1=6 mol L-1min-1,故答案为:<;减小;6mol/(Lmin);
(3)由图可知,t4时改变某一外界条件,正逆反应速率都增大,正反应速率小于逆反应速率,平衡向逆反应方向移动,该反应是一个气体体积增大的放热反应,升高温度或增大压强,平衡都向逆反应方向移动,则改变的条件可能是升高温度或增大压强;根据图像可知,从反应开始至t3时,反应一直是向正反应方向进行的,而从t4开始反应向逆反应方向进行,则表示平衡混合物中CO的含量最高的一段时间是t3~t4,故答案为:升高温度或增大压强;t3~t4。


科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)外观为半透明蓝绿色单斜结晶或颗粒,无气味。受热能分解,且在空气中易被氧化。
I.医学上绿矾可用于补血剂甘氨酸亚铁[(NH2CH2COO)2Fe]颗粒的制备,有关物质性质如下:
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
(1)向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为_______。
(2)制备(NH2CH2COO)2Fe:往FeCO3中加入甘氨酸(NH2CH2COOH)的水溶液,滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是__。
②洗涤操作,选用的最佳洗涤试剂是_______(填序号)。
A.热水 B.乙醇 C.柠檬酸
II.绿矾晶体受热分解的反应为2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
Fe2O3+SO2↑+SO3↑+14H2O,实验室用图I所示装置验证其分解产物。请回答下列问题:
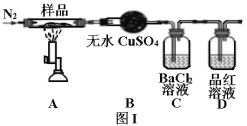
(1)加热前通入氮气的目的是_______。
(2)实验中观察到装置B现象为_______。
(3)C装置和D装置能否调换_______(填“能”或“否”)。
(4)样品完全分解后,残留物全部为红棕色固体,检验装置A中的残留物含有Fe2O3的方法是_______。
(5)该装置有个明显缺陷是_______。
III.测定绿矾样品中铁元素的含量。
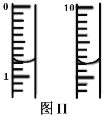
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L1 KMnO4 溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为_______(用含m、c的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,改变反应物中n(SO2),对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的影响如图所示,下列说法正确的是( )
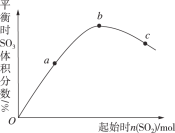
A.反应bc点均为平衡点,a点未达到平衡且向正反应方向进行
B.abc三点的平衡常数Kb>Kc>Ka
C.上述图象可以得出SO2的含量越高得到的混合气体中SO3的体积分数越高
D.abc三点中,a点时SO2的转化率最高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B.在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05molL-1下降到0.03molL-1,H2O2在这2h中分解的平均反应速率约为0.015molL-1h-1
C.其他条件相同时,升高温度,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D.一定条件下,固定体积的密闭容器中发生反应A(g)+B(g)2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积不变的密闭容器中,能表示反应: X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在以下各种情形下,下列电离方程式的书写正确的是
A.熔融状态下的NaHSO4电离:NaHSO4=Na++H++SO42-
B.H2CO3的电离:H2CO3![]() 2H++CO32-
2H++CO32-
C.Fe(OH)3的电离:Fe(OH)3![]() Fe3++3OH-
Fe3++3OH-
D.水溶液中的NaHSO4电离:NaHSO4=Na++HSO4-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )

A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应热的描述正确的是![]()
![]()
A.稀![]() 与NaOH固体反应生成
与NaOH固体反应生成![]() 放出的热量为中和热
放出的热量为中和热
B.反应条件与反应所需活化能有关,与反应热无关
C.若一个反应的反应物总键能大于生成物总键能,则反应![]()
D.已知![]() 的燃烧热为
的燃烧热为![]() ,则完全燃烧
,则完全燃烧![]() 生成水蒸气放出的热量大于
生成水蒸气放出的热量大于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00mL0.1000mol·L-1 HA溶液中逐滴加入0.1000mol·L-1NaOH溶液的pH与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )
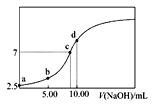
A.HA溶液的电离方程式为HA![]() H+ +A-
H+ +A-
B.恰好完全反应的点是c点
C.整个滴定过程中水的电离程度先增大后减小
D.点d所示溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com