
【题目】普伐他汀是一种调节血脂的药物,其结构如图所示(未表示出其空间构型).下列关于普伐他汀的性质描述正确的是( ) 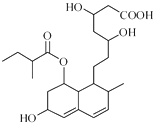
A.不能通过反应形成高分子化合物
B.不能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质最多可与1mol NaOH反应
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )
A.
用装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B.
装置的盐桥中KCl的Cl﹣移向甲烧杯
C.
装置中钢闸门应与外接电源的正极相连获得保护
D.
两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种物质中,所含化学键类型完全相同,晶体类型也完全相同的是( )
A.CO2、H2OB.NaOH、Na2OC.NaCl、HClD.SO2、SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度比为( )
A. 15∶2 B. 1∶1 C. 3∶1 D. 3∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不属于氧化还原反应的是( )
A. 3NO2+H2O=2HNO3+NO B. FeCl3+3H2O(沸水) ![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
C. SiO2+3C![]() SiC+2CO↑ D. Cu2O+2HCl=Cu+CuCl2+H2O
SiC+2CO↑ D. Cu2O+2HCl=Cu+CuCl2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫醉钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S203)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2SO4C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现将600mL稀硫酸等体积分为6份,并向其中5份中分别加入质量不等的Zn粒,并收集生成的氢气,有以下记录结果。(氢气的体积已折算为标准状况)
实验① | 实验② | 实验③ | 实验④ | 实验⑤ | |
Zn质量(g) | 5.0 | 8.0 | 12 | 14 | 16 |
H2体积(L) | 1.72 | 4.14 | 4.48 | 4.48 |
(1)由实验结果可推知,此稀硫酸的物质的量浓度为____________。
(2)实验②收集到H2的体积为____________。
(3)若向第6份稀硫酸中不断加入Zn粒,请在下图中画出H2体积(V)与Zn粒质量(m)的关系图像____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
(1)有科学家提出可利用FeO吸收和利用CO2 , 相关热化学方程式如下:6FeO(s)+CO2(g)=2Fe3O4(s)+C(s)△H=﹣76.0kJmol一1
上述反应中每生成1mol Fe3O4 , 转移电子的物质的量为mol.
(2)在一定条件下,二氧化碳转化为甲烷的反应如下:
CO2(g)+4H2 (g) C H4 (g)+2H2O(g),向一容积为2L的恒容密闭容器中充人一定量的CO2和H2 , 在300℃时发生上述反应,达到平衡时各物质的浓度分别为CO2 0.2molL一1 , H2 0.8molL一1 , CH40.8molL一1 , H2O1.6molL一1 . 则CO2的平衡转化率为300℃时上述反应的平衡常数K= . 200℃时该反应的平衡常数K=64.8,则该反应的△H(填“>’’或“<”)O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com