
【题目】醋酸亚铬水合物[Cr(CH3COO)2]2·2H2O是一种氧气吸收剂,为红棕色晶体,易被氧化,难溶于冷水,易溶于酸。其制备装置及步骤如下:

①检查装置气密性后,往三颈烧瓶中依次加入过量锌粒、适量CrCl3溶液。
②关闭K2,打开K1,旋开分液漏斗的旋塞并控制好滴速。
③待三颈烧瓶内的溶液由深绿色(Cr3+)变为亮蓝色(Cr2+)时,将溶液转移至装置乙中,当出现大量红棕色晶体时,关闭分液漏斗的旋塞。
④将装置乙中混合物快速过滤、洗涤和干燥,称量得到3.76 g [Cr(CH3COO)2]2·2H2O
(1)三颈烧瓶中的Zn与盐酸生成H2的作用____________,还发生的另一个反应的离子方程式为_______。
(2)实现步骤③中溶液自动转移至装置乙中的实验操作为______________,当乙中析出红棕色沉淀,为使沉淀充分析出并分离,需采用的操作是___________ 、_________、洗涤、干燥。
(3)装置丙中导管口水封的目的是______________。
(4)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的空气,再加入碱液,调节pH至少为___才能使铬的离子沉淀完全。(已知Cr(OH)3的溶度积为1×1032)
(5)若实验所取用的CrCl3溶液中含溶质6.34 g,则[Cr(CH3COO)2]2·2H2O (相对分子质量为376)的产率是____。
【答案】排除装置中的空气 2Cr3++Zn==2Cr2++Zn2+ 关闭k1,打开k2 冷却 过滤 防止空气进入装置乙中氧化Cr2+ 5 50%
【解析】
(1)产品易被氧化,因此生成H2的作用是排除装置中空气,防止醋酸亚铬水合物被氧化;锌为活泼金属,与Cr3+发生:Zn+2Cr3+=Zn2++2Cr2+;
(2)实现步骤③中溶液自动转移至装置乙中,利用三颈烧瓶的压强大,把液体压倒装置乙中,即打开k2,关闭k1;根据信息,醋酸亚铬水合物难溶于冷水,因此采用操作是冷却、过滤、洗涤、干燥;
(3)装置丙中导管口水封的目的是防止空气进入装置乙中氧化Cr2+;
(4)Cr3+完全转化成沉淀,c(Cr3+)≤10-5mol/l,因此有c(OH-)≥![]() =10-9mol·L-1,即pH至少为5,才能使Cr3+全部转化成沉淀;
=10-9mol·L-1,即pH至少为5,才能使Cr3+全部转化成沉淀;
(5)CrCl3的物质的量为6.34g/158.5g·mol-1=0.04mol,根据Cr元素守恒,[Cr(CH3COO)2]2·2H2O的物质的量为0.04mol/2=0.02mol,[Cr(CH3COO)2]2·2H2O的质量为0.02mol×376g·mol-1=7.52g,即产率为3.76g/7.52g×100%=50%。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】以二氧化钛表面覆盖Cu2A12O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示,下列说法不正确的是

A. 由图可知:乙酸的生成速率随温度升高而升高
B. 250~300℃时,温度升高而乙酸的生成速率降低的主要原因是催化剂的催化效率降低
C. 由300~400℃可知,其他条件相同时,催化剂的催化效率越低,乙酸的生成速率越大
D. 根据图象推测,工业上制备乙酸最适宜的温度应为250℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有_______________________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________,氧化产物是______。
(3)“碱浸”时生成CO2的电子式为_______,碱浸”时含钼化合物发生的主要反应的离子方程式为_____。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为______。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20molL1,c(SO42-)=0.01molL1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,去除的SO42-的质量分数为_____%。〔已知Ksp(BaSO4)=1×1010,Ksp(BaMoO4)=2.0×108〕
(6)钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:①A中反应为 KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为Ca(OH)2,其他杂质不参与反应。

(1)B装置作用____。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是_____。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入的物质正确的是___(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待E中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为___(填化学式)
(4)F装置的作用是(用化学方程式表示)____。
(5)为测定(3)中所得漂白粉的有效成份含量。称取ag漂白粉样品溶解,往所得溶液中通入 CO2至产生沉淀最大值时,该过程的化学方程式为_____,若反应生成沉淀的物质的量为bmol,则该漂白粉中有效成份的质量分数为_____(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5 (g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。 根据上图回答下列问题:

(l) PCl5分解成PC13和Cl2的热化学方程式是___________上述分解反应是一个可逆反应。温度T1时,在密闭容器中加人0.80 mol PCl5,反应达平衡时PCls还剩0.60 mol,其分解率a1等于____;若反应温度由T1升高到T2,平衡时PCls的分解率为a2,a2 ___a1(填“大于”、“小于”或“等于”);
(2)工业上制备PCl5通常分两步进行,先将P和CL2反应生成中间产物PC13,然后降温,再和Cl2反应生成PCl3原因是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D四种短周期元素在周期表中的相对位置如右表,其中D的原子序数是A的原子序数的3倍。A与D组成的物质是一种超硬耐磨涂层材料,图3为其晶体结构中最小的重复结构单元,其中的每个原子最外层均满足8电子稳定结构。下列有关说法正确的是

A. A与D组成的物质的化学式为BP,属于离子晶体
B. A与D组成的物质熔点高,且熔融状态下能导电
C. A与D组成的物质中原子间以共价键连接,属于原子晶体
D. A与D组成的化合物晶体中,每个A原子周围连接1个D原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷是一种有效、安全的固体储氢材料.氨硼烷的结构和乙烷相似,如图.
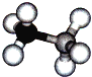
(1)氨硼烷的晶体类型为__.
(2)氮和硼比较,电负性大的元素为__(填元素符号).
(3)氨硼烷分子中氮原子、硼原子的杂化轨道类型分别为__和__.
(4)氨硼烷__(填“能”或“不能”)溶于水,其原因是__.
(5)以NaBH4为硼源、某配合物为氨源可用于制备氨硼烷.为测定该配合物的结构,取2.32g配合物进行如下实验:用重量法分析金属元素,测得镍元素的质量为0.59g;在碱性条件下加热蒸出NH3,用滴定法测出其物质的量为0.06mol;滴加过量硝酸银溶液,有白色沉淀生成,加热,沉淀没有增加;用摩尔法分析含量,测得氯元素质量为0.71g.
该配合物中镍离子的基态电子排布式为__.该配合物的化学式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。丙烷脱氢制丙烯发生的主要反应及能量变化如下图。

(1)丙烷脱氢制丙烯为强吸热过程。
①为提供反应所需热量,恒压时若向原料气中掺入水蒸气,则K(主反应)____(填“增大”、“减小”或“不变”,下同),转化率α(C3H8)_____。
②温度升高,副反应更容易发生的主要原因是__________________________________。
(2)下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分
别为104 Pa和105 Pa)。

①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
(3)利用CO2的弱氧化性,开发了丙烷氧化脱氢制丙烯的新工艺。
该工艺可采用铬的氧化物为催化剂,其反应机理如图。

已知:CO和H2的燃烧热分别为△H =-283.0 kJ·mol-1、△H =-285.8 kJ·mol-1。
①图中催化剂为______。
②298 K 时,该工艺总反应的热化学方程式为_____________________________________。
③该工艺可以有效消除催化剂表面的积炭,维持催化剂活性,原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(g)+B(g)![]() 2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
2C(g)+2D(s)在2 L密闭容器中进行,经过4min,B减少了0.4 mol,则0~4min内此反应的平均速率为
A. v(A)=0.15 mol·L1B. v(B)=0.05 mol·L1·s1
C. v(C)=0.10 mol·L1·min1D. v(D)=0.10 mol·L1·min1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com