
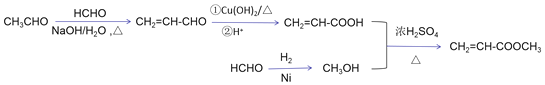
����Ŀ��������H��һ���л��������м��塣ʵ�����ɷ��㻯����A�Ʊ�H��һ�ֺϳ�·�����£�

��֪����RCHO+CH3CHO ![]() RCH=CHCHO+H2O����
RCH=CHCHO+H2O����![]() ��
��
�ش��������⣺
(1)C�Ľṹ��ʽΪ_______________________��
(2)F�й����ŵ�����Ϊ___________________��
(3)B������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽΪ________________��
(4)��ת������ͼ�ɼ�����D��E���������У����е�һ����Ӧ������Ϊ__________��
(5)������G�Ķ��ȴ�����__________��ͬ���칹�塣
(6)���㻯����X��D��ͬ���칹�壬X�ܷ���������Ӧ����˴Ź���������ʾ��3�ֻ�ѧ�������⣬�����֮��Ϊ6��1��1������������X�Ľṹ���ж��֣���д��2�ַ���Ҫ���X�Ľṹ��ʽ________��___________��
(7)д���ü�ȩ����ȩΪԭ���Ʊ�������CH2=CHCOOCH3�ĺϳ�·�ߣ������Լ���ѡ��____��
���𰸡�![]() CH=CH-COOH ̼̼����������
CH=CH-COOH ̼̼���������� ![]() ��ȥ��Ӧ 9
��ȥ��Ӧ 9 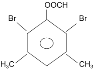
��������
����Ϣ�ٿ�֪AӦ����ȩ�����Һ���7��Cԭ�ӣ�ӦΪ![]() ����BΪ
����BΪ![]() ����CΪ
����CΪ![]() CH=CH-COOH��DΪ
CH=CH-COOH��DΪ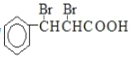 ��EΪ
��EΪ![]() �����Ҵ�����������Ӧ����FΪ
�����Ҵ�����������Ӧ����FΪ![]() ���Ա�F��H�Ľṹ��ʽ��֪GΪ
���Ա�F��H�Ľṹ��ʽ��֪GΪ![]() ���Դ˽��(1)��(4)��
���Դ˽��(1)��(4)��
(5)������GΪ![]() �Ķ���ͬ���칹����Ŀ�жϣ��ɸ���G�����к��е�Hԭ�ӵ����༰���λ�÷�����
�Ķ���ͬ���칹����Ŀ�жϣ��ɸ���G�����к��е�Hԭ�ӵ����༰���λ�÷�����
(6)D�ṹ��ʽΪ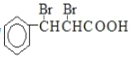 �����㻯����X��D��ͬ���칹�壬˵�����߷���ʽ��ͬ��X�ܷ���������Ӧ����ĿX����ȩ������˴Ź���������ʾ��3�ֻ�ѧ�������⣬�����֮��Ϊ6��1��1����3�ֲ�ͬλ�õ�Hԭ�ӣ����ǵĸ�����Ϊ6��1��1���ݴ���д�ṹ��ʽ��
�����㻯����X��D��ͬ���칹�壬˵�����߷���ʽ��ͬ��X�ܷ���������Ӧ����ĿX����ȩ������˴Ź���������ʾ��3�ֻ�ѧ�������⣬�����֮��Ϊ6��1��1����3�ֲ�ͬλ�õ�Hԭ�ӣ����ǵĸ�����Ϊ6��1��1���ݴ���д�ṹ��ʽ��
(7)��ȩ����ȩ������Ӧ����![]() �������ʱ�������Һ������Ȼ���ữ�ɵ�
�������ʱ�������Һ������Ȼ���ữ�ɵ�![]() ����ȩ��������ԭ�����״����״����ϩ�ᷢ��������Ӧ����Ŀ�����������ϩ�������
����ȩ��������ԭ�����״����״����ϩ�ᷢ��������Ӧ����Ŀ�����������ϩ�������
��������������֪AΪ![]() ��BΪBΪ
��BΪBΪ![]() ��CΪ
��CΪ![]() CH=CH-COOH��DΪ
CH=CH-COOH��DΪ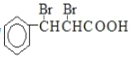 ��EΪ
��EΪ![]() ��FΪ
��FΪ![]() ��GΪ
��GΪ![]() ��
��
(1)C�Ľṹ��ʽΪ![]() CH=CH-COOH��
CH=CH-COOH��
(2)F�ṹ��ʽΪ![]() �����ݽṹ��ʽ��֪F�й�����Ϊ̼̼������������
�����ݽṹ��ʽ��֪F�й�����Ϊ̼̼������������
(3)B�ṹ��ʽΪ![]() ������ȩ����������Cu(OH)2����Һ�ڼ������ʱ������ѧ��Ӧȩ����������Ϊ�Ȼ����Ȼ������кͷ�Ӧ������������Σ�Cu(OH)2����ԭΪש��ɫ��Cu2O����Ӧ�Ļ�ѧ����ʽΪ
������ȩ����������Cu(OH)2����Һ�ڼ������ʱ������ѧ��Ӧȩ����������Ϊ�Ȼ����Ȼ������кͷ�Ӧ������������Σ�Cu(OH)2����ԭΪש��ɫ��Cu2O����Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
(4)DΪ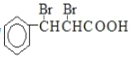 ��EΪ
��EΪ![]() ����ת������ͼ�ɼ�����D��E���������У����е�һ����Ӧ��±��ԭ����NaOH��Һ�ڷ�����ȥ��Ӧ���γ�̼̼������ͬʱ�Ȼ���Ӧ�����������Σ�������������
����ת������ͼ�ɼ�����D��E���������У����е�һ����Ӧ��±��ԭ����NaOH��Һ�ڷ�����ȥ��Ӧ���γ�̼̼������ͬʱ�Ȼ���Ӧ�����������Σ�������������![]() ��Ȼ����
��Ȼ����![]() ��ǿ�ᷴӦ����E��
��ǿ�ᷴӦ����E��![]() �����Ե�һ����Ӧ������Ϊ��ȥ��Ӧ��
�����Ե�һ����Ӧ������Ϊ��ȥ��Ӧ��
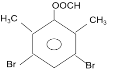
(5)������G�ṹΪ![]() ����G������Cԭ�ӱ��Ϊ
����G������Cԭ�ӱ��Ϊ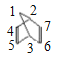 ������1��̼ԭ��һ�������2��3��Hԭ�ӵ�Ч��4��5��6��7��ԭ�ӵ�Ч���ɼ���G�к���3�ֲ�ͬλ�õ�Hԭ�ӣ�����ȴ�������2��Clԭ����ͬһλ���ϣ�ֻ����(1��1��)Cԭ����һ�����������������ͬCԭ���ϣ� 1��2 (��1��3) ��̼ԭ���ϣ���1��4(��1��5��1��6��1��7)��̼ԭ���ϣ� 2��3��̼ԭ���ϣ�2��4 (��2��7��3��5��3��6)��̼ԭ�ӣ�2��5 (��2��6��3��4��3��7)��̼ԭ�ӣ�4��5��(��6��7) ��̼ԭ���ϣ�4��6 (��5��7)��̼ԭ���ϣ�4��7 (��5��6)��̼ԭ���ϣ���9�ֲ�ͬ��ͬ���칹�壻
������1��̼ԭ��һ�������2��3��Hԭ�ӵ�Ч��4��5��6��7��ԭ�ӵ�Ч���ɼ���G�к���3�ֲ�ͬλ�õ�Hԭ�ӣ�����ȴ�������2��Clԭ����ͬһλ���ϣ�ֻ����(1��1��)Cԭ����һ�����������������ͬCԭ���ϣ� 1��2 (��1��3) ��̼ԭ���ϣ���1��4(��1��5��1��6��1��7)��̼ԭ���ϣ� 2��3��̼ԭ���ϣ�2��4 (��2��7��3��5��3��6)��̼ԭ�ӣ�2��5 (��2��6��3��4��3��7)��̼ԭ�ӣ�4��5��(��6��7) ��̼ԭ���ϣ�4��6 (��5��7)��̼ԭ���ϣ�4��7 (��5��6)��̼ԭ���ϣ���9�ֲ�ͬ��ͬ���칹�壻
(6)D��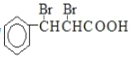 �����㻯����X��D��ͬ���칹�壬X�ܷ���������Ӧ����˴Ź���������ʾ��3�ֻ�ѧ�������⣬�����֮��Ϊ6��1��1��˵��X�Ľṹ�к��б�����ȩ�������ֲ�ͬ��Hԭ�ӣ����ǵĸ�����Ϊ6��1��1�������Ҫ���X�Ľṹ��ʽ����Ϊ
�����㻯����X��D��ͬ���칹�壬X�ܷ���������Ӧ����˴Ź���������ʾ��3�ֻ�ѧ�������⣬�����֮��Ϊ6��1��1��˵��X�Ľṹ�к��б�����ȩ�������ֲ�ͬ��Hԭ�ӣ����ǵĸ�����Ϊ6��1��1�������Ҫ���X�Ľṹ��ʽ����Ϊ ��
�� ��
��
(7)��ȩ����ȩ������Ӧ����CH2=CH-CHO�������ʱ�������Һ������Ȼ���ữ�ɵ�CH2=CH-COOH����ȩ��������ԭ�����״�CH3OH���״����ϩ�ᷢ��������Ӧ����Ŀ�����������ϩ�����CH2=CH-COOCH3����ϳ�����Ϊ ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.01mol I2��0.01mol H2����Ԥ�ȳ����յ�����2L�����ܱ������У�������1500K����ϵ�ﵽƽ�⣬��ѹǿΪ456 kPa����ϵ�д������·�Ӧ��ϵ��
I2(g)![]() 2I(g) ��H1 Kp1=2.00
2I(g) ��H1 Kp1=2.00
HI(g)![]() I(g)+H(g) ��H2 Kp2
I(g)+H(g) ��H2 Kp2
H2(g)![]() 2H(g) ��H3 Kp3=8��10-6
2H(g) ��H3 Kp3=8��10-6
I2(g)+H2(g)![]() 2HI(g) ��H4 Kp4
2HI(g) ��H4 Kp4
�ش��������⣺
(1) ��H4���H1����H2����H3�Ĺ�ϵ��_________________________��
(2) I2(g)+H2(g)![]() 2HI(g)��Ӧ�����еⵥ�ʵ�ת������ʱ��ı仯������ͼ��ʾ��A��ʱ��v��________(�>����<����=��)v����ǰ5minHI��������v(HI)=_____________________��
2HI(g)��Ӧ�����еⵥ�ʵ�ת������ʱ��ı仯������ͼ��ʾ��A��ʱ��v��________(�>����<����=��)v����ǰ5minHI��������v(HI)=_____________________��
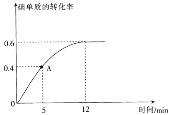
(3)�ﵽƽ��״̬ʱ�����������ʵ���������________________��Kp4=________________(KpΪ��ƽ���ѹ����Ũ�ȱ�ʾ��ƽ�ⳣ����ƽ���ѹ����ѹ�����ʵ�������)��
(4)����˵����˵������ϵ�ﵽƽ��״̬����________________��
A����ɫ���ٱ仯
B������ƽ����Է����������ٱ仯
C�������ܶȲ��ٱ仯
D���¶Ȳ��ٱ仯
(5)HI��һ��ǿ�ᣬ�����½�1.0mol��L-1��HI��Һ��amol��L-1�İ�ˮ�������Ϻ���Һ�����Դ�ʱ��Һ������Ũ�ȵĴ�С��ϵ��________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Ni2O3)������������ܵ��Ԫ������ⷨ�Ʊ��������£���NaOH ��Һ��NiCl2��Һ��pH����7.5(��pH����Һ�е�Ni2+������)���������������ƹ������е�⡣�������в�����Cl2(������Cl2���ݳ�)������������������ClO����ClO���ٰѶ��������ɼ�д��Ni2+������ΪNi3+���ٽ�Ni3+��һϵ�з�Ӧ��ת��ΪNi2O3�����װ����ͼ��ʾ������˵������ȷ���ǣ�������

A. �������������Ƶ���������������Ũ�ȣ���ǿ��Һ�ĵ�������
B. ������������������������Һ��pH������
C. ����1mol Ni2+����ΪNi3+ʱ�����·��ͨ���ĵ�����ĿΪ1NA��ͨ�������ӽ���Ĥ��Na+��ĿΪ1NA
D. ��Ӧǰ��b����Cl- Ũ�ȼ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ѫ��[�����軯�أ�K4Fe(CN)6]Ŀǰ�㷺����ʳƷ���Ӽ�(�����)���ҹ��������涨ʵ���л�Ѫ�ε����ʹ����Ϊ10mg/kg��һ���Ʊ���ѩ�εĹ������£�

�ش��������⣺
(1)�����Ӧ�Ļ�ѧ����ʽΪ__________________________��
(2)������������õķ�Һ�к����϶������Ϊ____________���ѧʽ����
(3)��������õ��Լ�X��___________�����ѧʽ��
(4)�������õ��綾��HCN��Һ����CN- �ķ�ˮ���봦��������ŷš�
��֪: HCN��һ�־��п�����ζ����ɫ�綾Һ�壬�ӷ���25��ʱKa(HCN)=6.25��10-10����Һ��H2CO3��HCO3-��CO32-�Ĵ�������ҺpH�Ĺ�ϵ��ͼ��ʾ��
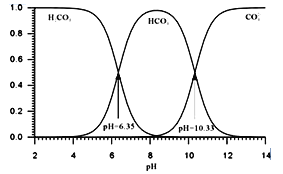
��NaCN�ĵ���ʽΪ___________��
�ڴ�����CN-��ˮ�ķ�������һ������pH>10����NaClO��Һ�Ƚ�CN-����ȫ����ΪOCN-���ڶ�������pHΪ7.5��8.5����NaClO��Һ��ȫ����OCN-����N2�������Ρ���һ������ǿ���Ե���ҪĿ����_______���ڶ�����Ӧ�����ӷ���ʽΪ____________��
(5)��֪��ɫȾ����³ʿ���ĺϳɷ������£�

����������������ֽ���Լ���ʳƷ���Ƿ���CN-���������£�

����ֽ������֤��ʳƷ�к���CN-��������³ʿ���ĺϳ�ԭ��������ͼ��ʱ��ֽ������ԭ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���е�NO�ǻ�����ѧ�о����ȵ���⡣
I��NO��������
��֪:2NO(g)+O2(g)===2NO2(g)��H=-110kJ��mol-1;25��ʱ,��NO��O2�����ʵ���֮��Ϊ2:1������Է�Ӧ������,�ò�ѹ���о��䷴Ӧ�Ľ����������ϵ����ѹǿp��ʱ��t�ı仯���±���ʾ(����NO2��N2O4��ת��)
t/min | 0 | 80 | 160 |
|
p/kpa | 75.0 | 63.0 | 55.0 | 55.0 |
(1)0~80min,v(O2)=_____kPa/min;���ŷ�Ӧ����,��Ӧ������С��ԭ����____����ѹǿ����Ũ�����õ���ƽ�ⳣ����K(p)��ʾ,25��ʱ,K(p)��ֵΪ____(����3λ��Ч����)��
(2)��������,�����ܷ�Ӧ2NOg)+O2(g)=2NO2(g)��������������
��һ��2NO(g)====N2O2(g) ���ٷ�Ӧ
�ڶ���N2O2(g)+O2(g)=2NO2(g) ����Ӧ
�ܷ�Ӧ������Ҫ�ɵ�______������;�����÷��Ӳ������ʵ����ٷ�Ӧ�����е�N2O2,�ܷ�Ӧ��ƽ�ⳣ��K(p)��___(����������������С������������);����߷�Ӧ�¶���35��,����ϵѹǿp��(35��)______p��(25��)(������������������������С����)��
II��NO�Ĺ�ҵ����
(3)H2��ԭ��:2NO(g)+2H2(g)===N2(g)+2H2O(g)����H=a;��֪�ڱ�״��,��Ԫ�����ȶ��ĵ�������1mol��������ʱ���ʱ�б�Ħ�������ʡ�NO(g)��H2O(g)�ı�Ħ�������ʷֱ�Ϊ+90kJ/mol��-280kJ/mol,��a=_____��
(4)O3-CaSO3���ϴ�����
NO�����Ⱦ�O3����,����CaSO3ˮ����Һ�������ɵ�NO2,ת��ΪHNO2,������Һ����NO2�Ļ�ѧ����ʽΪ__________;CaSO3ˮ����Һ�м���Na2SO4��Һ�����SO32-��NO2���������ʡ�����ƽ���ƶ�ԭ����������Ҫԭ��_________________(��ϻ�ѧ���������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����������ƽ���ƶ�ԭ������( )
A. ����ơ������ĭ�ݳ�
B. H2��I2��HIƽ��������ѹ����ɫ����
C. װ��NO2����ƿ������ˮ����ɫ����
D. ʵ�������ű���ʳ��ˮ�ķ����ռ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ϸ�˿��֮·����Ҫ�ڵ�,���ŷḻ��ͭ����ʯ��Դ���ش�����������⣺
(1)����Ԫ�����ڱ��е�λ����____,���̬ԭ�ӵĵ����Ų�ʽΪ_____,��ԭ�Ӻ�����___��δ�ɶԵ��ӡ�
(2)Ni(NH3)4SO4��N���ӻ����������_____;1 mol Ni(NH3)42+�к��е�![]() ����ĿΪ____��;SO42-�����幹����______��
����ĿΪ____��;SO42-�����幹����______��

(3)����_____����(���������������Ǽ�����),���ⶨNH4FΪ���Ӿ���,���NH3��H2O��ʾ��NH4F�����е����_____��
(4)ͭ���Ͻ�����������ṹ��ͼ��ʾ,����ԭ��A���������Ϊ(0,1,0);
��ԭ��B���������Ϊ____;
�����þ����ܶ�Ϊdg/cm3,��ͭ��ԭ�Ӽ���̾���Ϊ____pm
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ������������⣺
��1�����������ļ���ʽ _________________������ױ��Ľṹ��ʽ ____________________��![]() �ķ���ʽ ______________________��
�ķ���ʽ ______________________��
��2�����飨C5H12����ij��ͬ���칹��ֻ��һ��һ�ȴ�������Ľṹ��ʽ�� __________��
��3������ʽΪC4H9Cl�����ʣ���4��ͬ���칹�壬��д����4��ͬ���칹��Ľṹ��ʽ��___________, __________, __________, _________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com