
【题目】将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g)![]() 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g)![]() I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g)![]() 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g)![]() 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
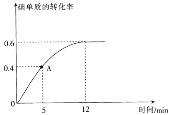
(2) I2(g)+H2(g)![]() 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
【答案】△H4=△H1+△H3-2△H2 > 8×10-4mol·L-1·min-1 0.2(或20%) 9 AD c(NH4+)=c(I-)>c(H+)=c(OH-)
【解析】
(1)根据盖斯定律:(1)I2(g)![]() 2I(g) △H1;(2)HI(g)
2I(g) △H1;(2)HI(g)![]() I(g)+H(g) △H2
I(g)+H(g) △H2
(3)H2(g)![]() 2H(g) △H3;由(1)-(2)+(3)得(4):I2(g)+H2(g)
2H(g) △H3;由(1)-(2)+(3)得(4):I2(g)+H2(g)![]() 2HI(g) 即△H4=△H1-2△H2+△H3;答案:△H4=△H1+△H3-2△H2。
2HI(g) 即△H4=△H1-2△H2+△H3;答案:△H4=△H1+△H3-2△H2。
(2) A点时反应没有达到平衡仍然向正反应方向进行,所以A点时v正>v逆;根据三段式
I2(g) + H2(g)![]() 2HI(g)
2HI(g)
初始量(mol) 0.01 0.01 0
变化量(mol) x x 2x
5min量(mol) 0.01-x 0.01-x 2x
由图像知5min时碘单质的转化率为0.4,所以x/0.01=0.4,x=0.004mol, 前5minHI的生成率=(0.004mol![]() 2)/2L
2)/2L![]() 5min=0.0008 mol·L-1·min-1;答案:>;8×10-4mol·L-1·min-1。
5min=0.0008 mol·L-1·min-1;答案:>;8×10-4mol·L-1·min-1。
(3) 达到平衡时碘单质的转化率为0.6,所以x/0.01=0.6,x=0.006mol, 根据三段式
I2(g) + H2(g)![]() 2HI(g)
2HI(g)
初始量(mol) 0.01 0.01 0,
变化量(mol) 0.006 0.006 0.012
平衡量(mol) 0.004 0.004 0.012
达到平衡状态时,氢气的物质的量分数是0.004/(0.004+0.004+0.012)![]() 100
100![]() = 20% ;
= 20% ;
平衡分压=总压×物质的量分数, 平衡时总压强为456 kPam,Kp4=c2(HI)/c(I2 )![]() c(H2)= (456
c(H2)= (456![]() 0.04)2 /(456
0.04)2 /(456![]() 0.04)
0.04)![]() (456
(456![]() 0.04)=9答案:20%;9。
0.04)=9答案:20%;9。
(4) 由I2(g) + H2(g)![]() 2HI(g)反应知A.颜色不再变化,说明I2的浓度不在改变,反应体系达到平衡状态,故A正确;B.气体平均相对分子质量M=m/n,因为m和n不变,M为定值,所以气体平均相对分子质量不再变化,不能说明反应体系达到平衡状态,故B错误;C.因为反应物和生物都是气体,在恒容条件下由
2HI(g)反应知A.颜色不再变化,说明I2的浓度不在改变,反应体系达到平衡状态,故A正确;B.气体平均相对分子质量M=m/n,因为m和n不变,M为定值,所以气体平均相对分子质量不再变化,不能说明反应体系达到平衡状态,故B错误;C.因为反应物和生物都是气体,在恒容条件下由![]() =m/v知气体密度是定值,所以气体密度不再变化不能说明反应体系达到平衡状态,故C错误;D.发生化学变化伴随着能量变化,所以温度不再变化说明反应体系达到平衡状态,故D正确;答案:AD。
=m/v知气体密度是定值,所以气体密度不再变化不能说明反应体系达到平衡状态,故C错误;D.发生化学变化伴随着能量变化,所以温度不再变化说明反应体系达到平衡状态,故D正确;答案:AD。
(5)HI是一种强酸,氨水为弱碱,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性,溶质为NH4I和氨水,根据电荷守恒,c(H+)+c(NH4+)=c(I-)+c(OH-) 因为cH+)= c(OH-),所以c(NH4+)=c(I-)。答案: c(NH4+)=c(I-)>c(H+)=c(OH-)。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】在下列反应中,水是氧化剂的是( )
A.2F2 +2H2O=4HF+O2
B.Cl2+H2OHCl+HClO
C.CaO+H2O=Ca(OH)2
D.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)O点为什么不导电_______。
(2)a、b、c三点c(H+)由大到小的顺序是_____。
(3)a、b、c三点中醋酸的电离程度最大的点是_____点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是____(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。则下列说法正确的是
A.甲的物质的量比乙的物质的量少B.甲的分子数比乙的分子数多
C.甲的体积比乙的体积大D.甲的相对分子质量比乙相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置正确且能达到对应实验目的的是
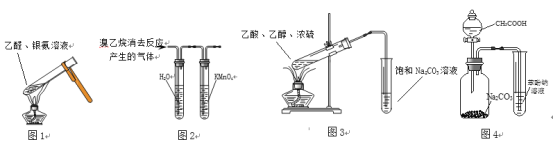
A. 用图1装置进行银镜反应
B. 用图2装置检验溴乙烷消去后的产物是否含乙烯
C. 用图3装置制备乙酸乙酯
D. 用图4装置比较乙酸、碳酸、苯酚的酸性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素。那么,牛和草体内的各种化学元素( )
A.种类差异很大,含量大体相同B.种类和含量差异都很大
C.种类和含量都是大体相同的D.种类大体相同,含量差异很大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:

已知:①RCHO+CH3CHO ![]() RCH=CHCHO+H2O;②
RCH=CHCHO+H2O;②![]() 。
。
回答下列问题:
(1)C的结构简式为_______________________。
(2)F中官能团的名称为___________________。
(3)B与新制Cu(OH)2悬浊液反应的化学方程式为________________。
(4)从转化流程图可见,由D到E分两步进行,其中第一步反应的类型为__________。
(5)化合物G的二氯代物有__________种同分异构体。
(6)芳香化合物X是D的同分异构体,X能发生银镜反应,其核磁共振氢谱显示有3种化学环境的氢,峰面积之比为6∶1∶1,符合条件的X的结构共有多种,任写出2种符合要求的X的结构简式________、___________。
(7)写出用甲醛和乙醛为原料制备化合物CH2=CHCOOCH3的合成路线(其他试剂任选)____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com