
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。则下列说法正确的是
A.甲的物质的量比乙的物质的量少B.甲的分子数比乙的分子数多
C.甲的体积比乙的体积大D.甲的相对分子质量比乙相对分子质量小
科目:高中化学 来源: 题型:
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的
A.NaOH(s)B.H2O(l)
C.NaHSO4(s)D.Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法、②水煤气(或氢气,或一氧化碳)法、③活泼金属置换法、④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜、(Ⅱ)湿法炼铜、(Ⅲ)铝热法炼铬、(Ⅳ)从光卤石中炼镁,对它们的冶炼方法分析不正确的是( )
A.Ⅰ用①B.Ⅱ用②C.Ⅲ用③D.Ⅳ用④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将CO2和H2O转换为燃料H2、CO及CH4的装置如图所示(电解质溶液为稀H2SO4)。下列关于该装置的叙述错误的是

A. 该装置可将电能转化为化学能
B. 工作时,电极a周围溶液的pH增大
C. 电极b上生成CH4的电极反应式为CO2+8H++8e-===CH4+2H2O
D. 若电极b上只产生1 mol CO,则通过质子膜的H+数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g)![]() 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g)![]() I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g)![]() 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g)![]() 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
(2) I2(g)+H2(g)![]() 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
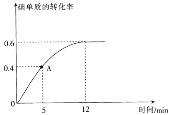
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.
(1)A中产生黄绿色气体,其电子式是 ______;A中使用KMnO4可以在不加热的情况下与浓盐酸发生反应。如果改用二氧化锰,则在加热条件下发生的化学反应方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是 ______ 。
(3)B中溶液发生反应的离子方程式是 ______ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ______。
(5)过程Ⅲ实验的目的是 ______ 。
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______ ,原因是:同主族元素从上到下 ______ ,得电子能力逐渐 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH 溶液将NiCl2溶液的pH调至7.5(该pH下溶液中的Ni2+不沉淀),加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2(不考虑Cl2的逸出)在弱碱性条件下生成ClO﹣,ClO﹣再把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3,电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阴、阳两极附近溶液的pH均升高
C. 当有1mol Ni2+氧化为Ni3+时,外电路中通过的电子数目为1NA,通过阳离子交换膜的Na+数目为1NA
D. 反应前后b池中Cl- 浓度几乎不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com