
【题目】牛通过吃草从草中获得化合物和元素。那么,牛和草体内的各种化学元素( )
A.种类差异很大,含量大体相同B.种类和含量差异都很大
C.种类和含量都是大体相同的D.种类大体相同,含量差异很大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g)![]() 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g)![]() I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g)![]() 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g)![]() 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
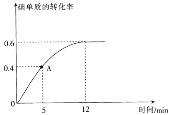
(2) I2(g)+H2(g)![]() 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某学习小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.
(1)A中产生黄绿色气体,其电子式是 ______;A中使用KMnO4可以在不加热的情况下与浓盐酸发生反应。如果改用二氧化锰,则在加热条件下发生的化学反应方程式为______。
(2)验证氯气的氧化性强于碘的实验现象是 ______ 。
(3)B中溶液发生反应的离子方程式是 ______ 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ______。
(5)过程Ⅲ实验的目的是 ______ 。
(6)实验结论:氯、溴、碘单质的氧化性逐渐 ______ ,原因是:同主族元素从上到下 ______ ,得电子能力逐渐 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,对碳、氮及化合物的研究备受关注。已知:
I.2C(s)+2NO(g)![]() N2(g)+2CO(g)
N2(g)+2CO(g) ![]() =-414.8kJ/mol
=-414.8kJ/mol
II.2CO(g)+O2(g)![]() 2CO2 (g)
2CO2 (g)![]() =-566kJ/mol
=-566kJ/mol
III.2CO(g)+2NO(g)![]() N2(g)+2CO2 (g)
N2(g)+2CO2 (g)![]() =-759.8kJ/mol
=-759.8kJ/mol
回答下列问题:
(l) N2的电子式为 ___ 。
(2)表示碳的燃烧热的热化学方程式为____。
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2 (g)=2CO2 (g)。向容积相同的恒容密闭容器中分别充入等量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(a)如图所示。

①由图推断下列说法正确的是 ___(填选项字母)。
A.a、b、c、d点均达到平衡状态B.该反应的平衡常数K(b)=K(c)
C.b点反应物的有效碰撞几率最大D.图中五个点对应状态下,a点反应速率最慢
②e点CO的转化率突然减小的可能原因为_______________________
③若b点容器中c(O2)=0.5 mol·L-l,则To℃时该反应的平衡常数K=________
(4) T1℃时,向刚性容器中充入2 mol NO和2 mol CO,发生反应Ⅲ。5 min时达到平衡状态,测得容器中n(N2) =0.8 mol、c(CO2)=0. 32 mol/L。
①0~5 min内,用NO表示的反应速率v(NO)=_________
②反应进行到2 min时,v正(CO) ___v逆(CO2)(填“>”“<”或“=”)。
③若升高温度,容器内气体压强____(填“增大”“减小”或“不变”),原因为 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高聚物M广泛用于各种刹车片。实验室以烃A为原料制备M的一种合成路线如下:

已知:

回答下列问题:
(1)A的结构简式为____。H的化学名称为_____。
(2)B的分子式为____。C中官能团的名称为____。
(3)由D生成E、由F生成G的反应类型分别为____、_____。
(4)由G和I生成M的化学方程式为____。
(5)Q为I的同分异构体,同时满足下列条件的Q的结构简式为____。
①1 moi Q最多消耗4 mol NaOH ②核磁共振氢谱有4组吸收峰
(6)参照上述合成路线和信息,以甲苯为原料(无机试剂任选),设计制备![]() 的合成路线_____________________。
的合成路线_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH 溶液将NiCl2溶液的pH调至7.5(该pH下溶液中的Ni2+不沉淀),加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2(不考虑Cl2的逸出)在弱碱性条件下生成ClO﹣,ClO﹣再把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3,电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阴、阳两极附近溶液的pH均升高
C. 当有1mol Ni2+氧化为Ni3+时,外电路中通过的电子数目为1NA,通过阳离子交换膜的Na+数目为1NA
D. 反应前后b池中Cl- 浓度几乎不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云南是南方丝绸之路的重要节点,有着丰富的铜镍矿石资源。回答下列相关问题:
(1)镍在元素周期表中的位置是____,其基态原子的电子排布式为_____,该原子核外有___个未成对电子。
(2)Ni(NH3)4SO4中N的杂化轨道类型是_____;1 mol Ni(NH3)42+中含有的![]() 键数目为____个;SO42-的立体构型是______。
键数目为____个;SO42-的立体构型是______。

(3)氨是_____分子(填“极性”或“非极性”),经测定NH4F为分子晶体,类比NH3·H2O表示出NH4F分子中的氢键_____。
(4)铜镍合金的立方晶胞结构如图所示,其中原子A的坐标参数为(0,1,0);
①原子B的坐标参数为____;
②若该晶体密度为dg/cm3,则铜镍原子间最短距离为____pm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com