
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)O点为什么不导电_______。
(2)a、b、c三点c(H+)由大到小的顺序是_____。
(3)a、b、c三点中醋酸的电离程度最大的点是_____点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是____(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
【答案】冰醋酸中只有分子,无自由移动的离子 b>a>c c ACEF
【解析】
(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,“O”点冰醋酸未电离,其中没有自由移动的离子,所以冰醋酸不导电;
(2)导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度由小到大的顺序为为c<a<b;
(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度最大的是c;
(4)A、加热促进醋酸电离,则溶液中醋酸根离子浓度增大,故正确;
B、加很稀的NaOH溶液,促进醋酸电离,但溶液的体积增大,导致醋酸根离子浓度减小,故错误;
C、加KOH固体,氢氧化钾和氢离子反应促进醋酸电离,所以醋酸根离子浓度增大,故正确;
D、加水稀释能促进醋酸电离,但醋酸根离子浓度减小,故错误;
E、加固体CH3COONa,能抑制醋酸电离,但醋酸钠电离出的醋酸根离子大于抑制醋酸电离出的醋酸根离子,所以醋酸根离子浓度增大,故正确;
F、加入锌粒,和氢离子反应,促进醋酸电离,所以醋酸根离子浓度增大,故正确;
答案选ACEF。


科目:高中化学 来源: 题型:
【题目】在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是
A. α1<α3<α2<α4 B. α3<α2<α1<α4 C. α2=α3<α1<α4 D. α2=α3<α4<α1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为__________%,表中c2_____c3、a_____b(填“>”、“<”或“=”)。
(2)20s时四氧化二氮的浓度c1=_________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为______________mol/(L·s)。
(3)100℃时,该反应的平衡常数K = ______________________
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应的速率,且不影响生成H2的总量,可向反应容器中加入适量的
A.NaOH(s)B.H2O(l)
C.NaHSO4(s)D.Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法、②水煤气(或氢气,或一氧化碳)法、③活泼金属置换法、④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜、(Ⅱ)湿法炼铜、(Ⅲ)铝热法炼铬、(Ⅳ)从光卤石中炼镁,对它们的冶炼方法分析不正确的是( )
A.Ⅰ用①B.Ⅱ用②C.Ⅲ用③D.Ⅳ用④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.01mol I2和0.01mol H2置于预先抽成真空的特制2L恒容密闭容器中,加热至1500K,体系达到平衡,总压强为456 kPa。体系中存在以下反应关系:
I2(g)![]() 2I(g) △H1 Kp1=2.00
2I(g) △H1 Kp1=2.00
HI(g)![]() I(g)+H(g) △H2 Kp2
I(g)+H(g) △H2 Kp2
H2(g)![]() 2H(g) △H3 Kp3=8×10-6
2H(g) △H3 Kp3=8×10-6
I2(g)+H2(g)![]() 2HI(g) △H4 Kp4
2HI(g) △H4 Kp4
回答下列问题:
(1) △H4与△H1、△H2、△H3的关系是_________________________。
(2) I2(g)+H2(g)![]() 2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
2HI(g)反应过程中碘单质的转化率随时间的变化曲线如图所示,A点时,v正________(填“>”“<”“=”)v逆,前5minHI的生成率v(HI)=_____________________。
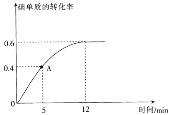
(3)达到平衡状态时,氢气的物质的量分数是________________;Kp4=________________(Kp为用平衡分压代替浓度表示的平衡常数,平衡分压=总压×物质的量分数)。
(4)下列说法能说明该体系达到平衡状态的是________________。
A.颜色不再变化
B.气体平均相对分子质量不再变化
C.气体密度不再变化
D.温度不再变化
(5)HI是一种强酸,常温下将1.0mol·L-1的HI溶液和amol·L-1的氨水等体积混合后,溶液呈中性此时溶液中离子浓度的大小关系是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com