
【题目】在100℃时,将0.200 mol的四氧化二氮气体充入2 L真空的密闭容器中,每隔一定的时间对该容器内的物质进行分析,得到如下表格:
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
(1)该反应达到平衡时,四氧化二氮的转化率为__________%,表中c2_____c3、a_____b(填“>”、“<”或“=”)。
(2)20s时四氧化二氮的浓度c1=_________mol/L,在0 s~20 s时间段内,四氧化二氮的平均反应速率为______________mol/(L·s)。
(3)100℃时,该反应的平衡常数K = ______________________
(4)若在相同情况下最初向该容器充入的是二氧化氮气体,要达到上述同样的平衡状态,二氧化氮的起始浓度是_____________mol/L。
【答案】60 > = 0.070 0.0015 0.36 0.2
【解析】
由表格数据可知,c(N2O4)减少,c(NO2)增大,60s后不再变化,则建立如下三段式:
N2O4![]() 2NO2
2NO2
开始(mol/L)0.100 0
转化(mol/L)0.06 0.12
平衡(mol/L)0.04 0.12
达到平衡时四氧化二氮的转化率为0.06 mol/L÷0.100mol/L×100%=60%;根据表中数据40s时c2=0.10mol/L,60s时c3=0.04mol/L,c2>c3,60s时c(NO2)不再变化,反应达到平衡,a=b,故答案为:60;>;=;
(2)由表可知,20s时,c(NO2)=0.060mol/L,所以20s时四氧化二氮的浓度c1=0.1mol/L-0.03mol/L=0.07mol/L;在0s~20s内四氧化二氮的平均反应速率为υ(N2O4)=0.03mol/L÷20s=0.0015 mol/(L·s)故答案为:0.070;0.0015;
(3) 平衡常数K= c2(NO2)/ c(N2O4) =(0.12 mol/L)2/(0.04mol/L) =0.36mol/L,故答案为:0.36mol/L;
(4) 恒温恒容条件下,且反应前后气体的物质的量发生变化,起始向容器中充入的是二氧化氮气体,要达到相同的平衡状态,按化学计量数转化到N2O4一边,满足N2O4的浓度为0.100mol/L,由N2O4(g)~2NO2(g)可知,二氧化氮的初始浓度=2×0.100mol/L=0.200mol/L,故答案为:0.200。


科目:高中化学 来源: 题型:
【题目】(化学----选修5:有机化学基础)
![]() 是药物合成中的一种重要中间体,下面是
是药物合成中的一种重要中间体,下面是![]() 的一种合成路线:
的一种合成路线:

已知: 。
。
请回答下列问题:
(1)![]() 所含官能团的名称为___________;
所含官能团的名称为___________;![]() 的结构简式为_______________,
的结构简式为_______________,![]() 生成
生成![]() 的反应类型为_______________________。
的反应类型为_______________________。
(2)![]() 的名称是____________。
的名称是____________。
(3)由![]() 和
和![]() 合成
合成![]() 的化学方程式为______________________。
的化学方程式为______________________。
(4)![]() 的同分异构体中,能发生银镜反应且分子结构中含苯环的还有_______________种,其中核磁共振氢谱上有6组峰,峰面积之比为1:1:1:1:1:1的同分异构体的结构简式为__________(一种即可)。
的同分异构体中,能发生银镜反应且分子结构中含苯环的还有_______________种,其中核磁共振氢谱上有6组峰,峰面积之比为1:1:1:1:1:1的同分异构体的结构简式为__________(一种即可)。
(5)参照上述合成路线,以![]() 为原料(其他试剂任选),设计制备巴豆醛(
为原料(其他试剂任选),设计制备巴豆醛(![]() )的合成路线。________________________________________
)的合成路线。________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) ![]() 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
A. 密闭容器中混合气体的密度不变
B. 2v(NH3)正=v(CO2)逆
C. 密闭容器中c(NH3)∶c(CO2)=2∶1
D. 密闭容器中c(NH3)和c(CO2)浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列现象和用途中,浓硫酸表现脱水性的是( )
A.实验室制取氯气时浓硫酸做干燥剂
B.浓硫酸使火柴梗变黑
C.浓硫酸滴到胆矾上,蓝色晶体变成白色粉末
D.浓硫酸与碳单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
① H2(g) + ![]() O2(g) = H2O(
O2(g) = H2O(![]() );△H = -285kJ/mol
);△H = -285kJ/mol
② H2O(g) = H2(g) + ![]() O2(g); △H = + 241.8kJ/mol
O2(g); △H = + 241.8kJ/mol
③ C(s) + ![]() O2(g) = CO(g); △H = -110.4kJ/mol
O2(g) = CO(g); △H = -110.4kJ/mol
④ C(s) + O2(g) = CO2(g);△H = -393.5kJ/mol
回答下列各问:
(1)上述反应中属于放热反应的是______________。(用序号填写)
(2)燃烧10g H2生成液态水,放出的热量为_____________。
(3)CO的燃烧热的热化学方程式为___________________________________。
(4)已知常温下拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为:___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示。请回答:

(1)O点为什么不导电_______。
(2)a、b、c三点c(H+)由大到小的顺序是_____。
(3)a、b、c三点中醋酸的电离程度最大的点是_____点。
(4)若使c点溶液中的c(CH3COO-)提高,可采取的措施是____(填标号)。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E.加固体CH3COONa F.加锌粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.28g聚乙烯中含有NA个碳碳双键
B.1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气的分子数最多为6NA
C.标准状况下,2.24LCCl4中的原子总数等于0.5NA
D.15g甲基含有的电子数是9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种锂离子二次电池,其工作原理如图。放电时生 成的Li2CO3固体和碳储存于碳纳米管中。下列说法错误的是
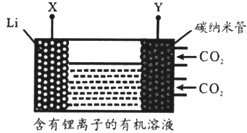
A. 该电池中的有机溶剂不能含活性较大的氢
B. 充电时,Y为阳极,Li+向X电极移动
C. 放电时,负极反应为2Li+CO32-—2e-===Li2CO3
D. 放电时,电池总反应为3CO2+4Li===2Li2CO3+C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com