
【题目】对于常温下pH= 3的乙酸溶液,下列说法正确的是
A.c(H+)=c(CH3COO-)+c(OH-)
B.加水稀释到原体积的10倍后溶液pH变为4
C.加入少量乙酸钠固体,溶液pH降低
D.与等体积pH=11的NaOH溶液混合后所得溶液中c(Na+)=c(CH3COO-)
【答案】A
【解析】
A.乙酸溶液中乙酸和水都能部分电离,则溶液中存在氢离子、乙酸根离子、氢氧根离子,由于电解质溶液呈电中性,则c(H+)=c(CH3COO-)+c(OH-),故A正确;
B.pH=3,则溶液中c(H+)=1.0×10-3 mol·L-1,稀释10倍后溶液中c(H+)不是1.0×10-4 mol·L-1,因为乙酸在水中存在电离平衡,稀释能使CH3COOH![]() H++CH3COO-平衡向电离方向移动,促进乙酸电离,所以稀释10倍后溶液中c(H+)大于1.0×10-4 mol·L-1,因此溶液pH<4,故B错误;
H++CH3COO-平衡向电离方向移动,促进乙酸电离,所以稀释10倍后溶液中c(H+)大于1.0×10-4 mol·L-1,因此溶液pH<4,故B错误;
C.乙酸钠是溶于水完全电离的强电解质,加入少量乙酸钠固体,增大乙酸根离子浓度,使CH3COOH![]() H++CH3COO-平衡向逆反应方向移动,则溶液中氢离子减小,由于pH=—lg c(H+),所以溶液的pH增大或升高,故C错误;
H++CH3COO-平衡向逆反应方向移动,则溶液中氢离子减小,由于pH=—lg c(H+),所以溶液的pH增大或升高,故C错误;
D.氢氧化钠溶液中c(OH-)=Kw/c(H+)=Kw/10-pH="0.001" mol·L-1,乙酸溶液中c(H+)=1.0×10-3 mol·L-1,由于n=cV,则混合前氢氧化钠溶液中氢氧根离子的物质的量等于乙酸溶液中氢离子的物质的量,二者混合时H+与OH-发生中和反应,氢氧化钠是强电解质,不可能继续电离出氢氧根离子,而乙酸是弱电解质,随着氢离子的消耗,CH3COOH![]() H++CH3COO-平衡向电离方向移动,乙酸能继续电离出氢离子,所以混合后氢氧化钠溶液中氢氧根离子的物质的量小于乙酸溶液中氢离子的物质的量,则氢离子过量,所得溶液显酸性,c(H+)>c(OH-),混合溶液存在氢离子、钠离子、乙酸根离子和氢氧根离子,根据电荷守恒原理,则c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),由于,c(H+)>c(OH-),则c(Na+)<c(CH3COO-),故D错误。
H++CH3COO-平衡向电离方向移动,乙酸能继续电离出氢离子,所以混合后氢氧化钠溶液中氢氧根离子的物质的量小于乙酸溶液中氢离子的物质的量,则氢离子过量,所得溶液显酸性,c(H+)>c(OH-),混合溶液存在氢离子、钠离子、乙酸根离子和氢氧根离子,根据电荷守恒原理,则c(H+)+ c(Na+)= c(CH3COO-)+ c(OH-),由于,c(H+)>c(OH-),则c(Na+)<c(CH3COO-),故D错误。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氮化碳结构如下图所示,其硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是 ( )
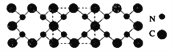
A. 氮化碳属于原子晶体
B. 氮化碳中碳显-4价,氮显+3价
C. 氮化碳的化学式为C3N4
D. 每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学配置450毫升 1mol/L的硫酸溶液
(1)应该选择________的容量瓶 A 250毫升 B 500毫升 C 1000毫升
(2)需要量取98%,ρ=1.84g/cm3浓硫酸__________毫升
(3)将所取浓硫酸逐滴加入盛有水的烧杯中,边加边搅拌
(4)将该溶液注入容量瓶
(5)在容量瓶中加水至___________处,改用__________加水至_______与刻度线相切
(6)塞好瓶塞,反复摇匀
(7)摇匀后发现,溶液体积缩小,继续加水至刻度线
(8)该同学的操作是否有不当之处,请指出(不必全部填满)
a__________________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
b____________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
c_______________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
d____________该错误操作将使所配溶液的浓度_______(“变大”或“变小”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.SO2通入已酸化的Ba(NO3)2溶液中
C.NH3通入AlCl3溶液中
D.CO2通入CaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
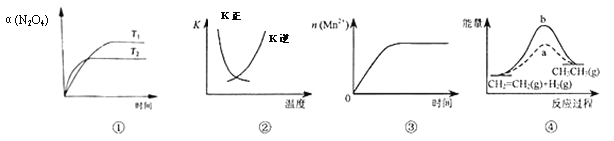
A. 图①表示N2O4(g)![]() 2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
2NO2(g) ΔH>0,N2O4转化率随温度、时间的变化
B. 图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
2SO3(g) ΔH<0,正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL0.01 mol/LKMnO4酸性溶液与过量0.1mol/LH2C2O4溶液混合时,n(Mn2+)随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)![]() CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g) ΔH<0,使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型药物H(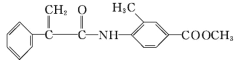 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:
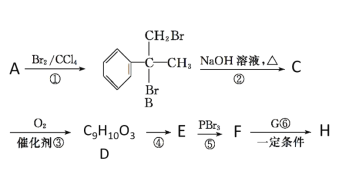
已知:①E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色;
②RCOOH![]()
![]() (R为烃基);
(R为烃基);
③![]()
![]()
![]() 。
。
请回答下列问题:
(1)A的结构简式为________;D的官能团的名称为____________。
(2)①的反应类型是________。
(3)写出B→C的化学方程式: ______________________________________。
(4)E有多种同分异构体,同时满足下列条件的E的同分异构体的结构简式_______。
ⅰ.能发生银镜反应
ⅱ.能发生水解反应
ⅲ.分子中含的环只有苯环,且苯环上只有一个取代基。
(5)参照合成H的上述路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线。
________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2A+B![]() 3C+4D,表示反应速率最快的是
3C+4D,表示反应速率最快的是
A.VA=0.75mol/(L·s)B.VB=0.5mol/(L·s)C.VC=1.0mol/(L·s)D.VD=1.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下:
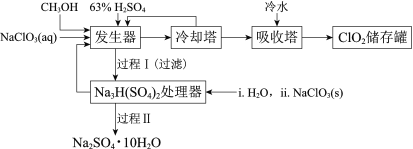
已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH= 12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2O
b.相关物质的熔沸点:
物质 | CH3OH | HCOOH | ClO2 |
熔点/℃ | -97 | 9 | -59 |
沸点/℃ | 65 | 101 | 11 |
(1)ClO2可用于纸浆漂白、杀菌消毒是因其具有______性。
(2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为______(填字母)。
A.0~10℃ B.20~30℃ C.60~70℃
(3)经过程Ⅰ和过程Ⅱ可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。
已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如下图:
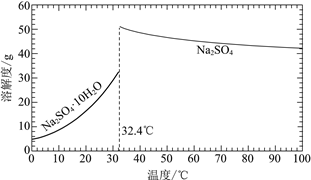
①Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因:______。
②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,______。
③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com