
【题目】金刚烷是一种是重要的化工原料,工业上可通过下列途径制备:

(1)环戊二烯分子中最多有________个原子共面。
(2)金刚烷的分子式为________,其分子中的CH2基团有________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线

其中,反应①还需要的反应试剂是______,反应类型是____,反应③的反应类型是_________;
【答案】9 C10H16 6 Cl2 取代反应 加成反应
【解析】
(1)C=C为平面结构,与双键碳直接相连的原子一定在同一平面内;
(2)金刚烷的分子中有6个CH2,4个CH结构;
(3)由合成路线可知,反应①为光照条件下的取代反应,反应②为消去反应,反应③为加成反应,反应④为消去反应;
(1)C=C平面结构,与双键碳直接相连的原子一定在同一平面内,根据环戊二烯的结构可知,5个C和4个H都有可能在同一平面内;
(2)由C原子形成4个共价键,由结构简式可知金刚烷的分子中有6个CH2,4个CH结构,分子式为C10H16;
(3)由合成路线可知,反应①为光照条件下的取代反应,需要的试剂为Cl2;反应②为消去反应,反应③为加成反应,反应④为消去反应;


科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请按要求回答下列问题:
(1)元素①与⑨组成的化合物的电子式:_______;元素②的原子结构示意图_______。
(2)对比相同条件下元素⑥、⑦的单质分别与水反应的剧烈程度,可得到的结论:同一周期元素,随核电荷数的增加,_______;写出元素⑥的单质与水反应的化学方程式_______。
(3)能说明元素⑤的非金属性强于元素⑨的依据是_______。
(4)元素①与②所形成的最简单有机物的结构式是_______。元素①与②所形成的最简单烯烃为M,写出M与元素①的单质在一定条件下反应的化学方程式:_______,该反应类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
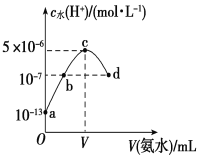
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Ai2O3、 Fe2O3 、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)“碱溶”时,Ai2O3发生反应的化学方程式____________ 。
(2)“酸溶II”时 ,Fe3O4发生反应的离子方程式为_________
(3)“滤渣I”、“滤渣II”在本流程中能加以利用的是________
(4)酸度对絮凝效果和水质有显著影响。若产品PFAS中残留硫酸过多,使用时产生的不良后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成的物质的量随加入NaOH溶液体积的变化如下图A所示。则有关说法中不正确的是

A.a的取值范围为0a<50
B.![]() 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由煤炭出发制取有机化工原料乙炔,流程如下。回答以下问题:
![]()
(1)由煤炭得到焦炭的工业操作为_____________。
a.分馏 b.干馏 c.裂化 d.裂解
(2)实验室用电石(CaC2)来制备乙炔,反应的化学方程式为:___________。乙炔是一种稍有气味的气体,但实验室制备的乙炔气体具有令人厌恶的刺激性气味,可用某种溶液进行检验,写出检验此气体的化学方程式:___________
(3)乙炔能使溴水褪色,说明乙炔发生_____________反应(反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被_____________。导电高分子是以聚乙炔为载体的高聚物,写出反应Ⅱ的化学方程式:_____________。
(4)乙炔在一定条件下,三聚得到CH2﹦CH—C≡C—CH﹦CH2:,写出该三聚物具有相同化学式且不易发生加成反应物质的结构简式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO3与SnCl2在浓盐酸中反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M。关于该反应的说法中错误的是
A.M为H2O
B.还原剂是Sn2+,还原产物是As
C.氧化性:H3AsO3>SnCl62-
D.每生成7.5 g As,转移的电子为0.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的价电子排布式为______________________。
(2)A的最高价氧化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________(填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________。
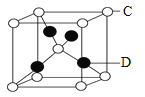
(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com