
【题目】工业上由煤炭出发制取有机化工原料乙炔,流程如下。回答以下问题:
![]()
(1)由煤炭得到焦炭的工业操作为_____________。
a.分馏 b.干馏 c.裂化 d.裂解
(2)实验室用电石(CaC2)来制备乙炔,反应的化学方程式为:___________。乙炔是一种稍有气味的气体,但实验室制备的乙炔气体具有令人厌恶的刺激性气味,可用某种溶液进行检验,写出检验此气体的化学方程式:___________
(3)乙炔能使溴水褪色,说明乙炔发生_____________反应(反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被_____________。导电高分子是以聚乙炔为载体的高聚物,写出反应Ⅱ的化学方程式:_____________。
(4)乙炔在一定条件下,三聚得到CH2﹦CH—C≡C—CH﹦CH2:,写出该三聚物具有相同化学式且不易发生加成反应物质的结构简式:_________________。
【答案】b CaC2+2H2O=Ca(OH)2+C2H2↑ H2S+Pb(NO3)2=PbS↓+2HNO3 加成 氧化 n CH≡CH ![]() -[-CH=CH-]-n
-[-CH=CH-]-n 
【解析】
煤炭通过干馏得到焦炭,焦炭与氧化钙作用得到CaC2,电石与水反应生成乙炔,含有碳碳三键可以发生加聚反应生成导电高分子。
(1)由煤炭得到焦炭的工业操作为干馏,所以选b;
(2)电石与水反应生成乙炔,方程式为CaC2+2H2O=Ca(OH)2+C2H2↑;电石中常含有CaS等杂质与水反应生成H2S,具有令人厌恶的刺激性气味,可用硝酸铅检验,产生黑色沉淀,方程式为H2S+Pb(NO3)2=PbS↓+2HNO3;
(3)乙炔含有碳碳三键可与溴水发生加成反应使溴水褪色;能使酸性高锰酸钾褪色说明其容易被氧化;乙炔发生加聚反应生成高聚物,方程式为n CH≡CH ![]() -[-CH=CH-]-n;
-[-CH=CH-]-n;
(4)三聚物的分子式为C6H6,具有相同化学式且不易发生加成反应的物质为苯,结构简式为 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2C2O4溶液中滴加盐酸,混合溶液的pH与离子浓度变化关系如图所示。已知H2C2O4是二元弱酸,X表示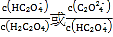 ,下列叙述错误的是
,下列叙述错误的是
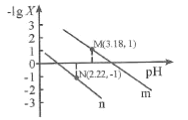
A.从M点到N点的过程中,c(H2C2O4)逐渐增大
B.直线n表示pH与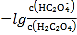 的关系
的关系
C.由N点可知Ka1 (H2C2O4)的数量级为10 -2
D.pH=4.18的混合溶液中:c(Na+)>c(HC2O4-)= c(C2O42-) =c(Cl-)> c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷是一种是重要的化工原料,工业上可通过下列途径制备:

(1)环戊二烯分子中最多有________个原子共面。
(2)金刚烷的分子式为________,其分子中的CH2基团有________个;
(3)下面是以环戊烷为原料制备环戊二烯的合成路线

其中,反应①还需要的反应试剂是______,反应类型是____,反应③的反应类型是_________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】功能高分子P的合成路线如下:
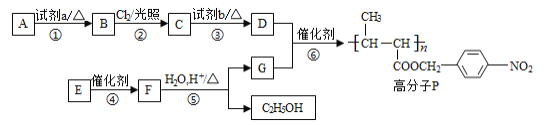
(1)A的分子式是C7H8,其结构简式是________。
(2)试剂a是_______。
(3)反应③的化学方程式:________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________。
(5)反应④的反应类型是________。
(6)反应⑤的化学方程式:________。
(7)已知:2CH3CHO ![]() 。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() (I)
(I)![]()
![]()
![]()
![]()
![]() (J)
(J)![]() E
E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NO、NO2、SO2都是大气污染物,减少这些氧化物排放对于环境保护具有重要的意义。
已知下列热化学方程式
C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH2=+68kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH3=-221.0kJ·mol-1
(1)2NO2(g)+4CO(g)=4CO2(g)+N2(g)ΔH=__kJ·mol-1。
①某温度下,在2L密闭容器中充入0.4mo1CO和0.6molNO2,此时容器的压强为2.0×105Pa,5s时,容器的压强变为原来的0.95倍,则从反应开始到5秒末NO2的平均反应速率v(NO2)=__mol/(L·s)。
②下列能使该反应的反应速率增大,且平衡向正反应方向移动的是__。
A.适当升高温度
B.减小容器体积使体系压强增大
C.及时分离出CO2
D.向密闭容器中再充入0.4molNO2
(2)某温度下,下列反应的平衡常数如下:
a.2NO2(g)N2(g)+2O2(g) K1=7.0×1016
b.2NO(g)N2(g)+O2(g) K2=2.1×1030
反应2NO(g)+O2(g)2NO2(g)的平衡常数K3=__。
(3)在催化剂作用下用CO还原NO2进行尾气处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成N2的物质的量与时间变化如图a。活化能最小的是_(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。

②在催化剂B作用下,测得相同时间内,处理NO2的量与温度的关系如图b。图中曲线先增大后减小,请说明后减小的原因___(假设该温度范围内催化效率相同)。

(4)煤燃烧产生的SO2用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可以制备H2SO4,其原理如图c所示(电极材料为石墨)。a电极反应式为__。b为_(阴、阳)极,d离子交换膜为__(阴、阳)离子交换膜。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A.干粉灭火器和泡沫灭火器的工作原理相同
B.实验室配制1.0 molL-1的NaOH溶液定容时俯视刻度线,配制溶液浓度偏低
C.国产大飞机C919发动机使用的氮化硅属于无机非金属材料
D.冰水混合物、四氧化三铁、纯净矿泉水都不是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期主族元素,其中A是元素周期表中原子半径最小的元素;B是形成化合物种类最多的元素;C是地壳中含量最多的元素;D的气态氢化物的水溶液显碱性;E金属制成金属板后,经加工可制成一种高质量的反光镜,该金属粉末和氧化铁混合常用于焊接钢轨.
(1)写出C、E的元素符号______、______。
(2)B元素位于周期表中的位置为______,BC2的电子式为______(用元素符号表示)。
(3)A、B、C、D的原子半径由大到小的顺序为______(用元素符号表示)。
(4)E的最高价氧化物对应的水化物与短周期元素中最高价氧化物对应水化物碱性最强的物质在溶液中反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胃舒平主要成分是氢氧化铝,同时含有三硅酸镁(![]() )等化合物。
)等化合物。
(1)铝单质与同周期中非金属性最强的元素的气态氢化物的水溶液之间发生反应的离子方程式为:____________
(2)某元素与铝元素同周期且原子半径比镁原子半径大,写出该元素符号______,该元素的最高价氧化物的水化物与铝元素的最高价氧化物的水化物之间发生反应的离子方程式为:______________
(3)![]() 、MgO和
、MgO和![]() 都可以制耐火材料,其原因是______
都可以制耐火材料,其原因是______
a. ![]() 、MgO和
、MgO和![]() 都是白色固体
都是白色固体
b. ![]() 、MgO和
、MgO和![]() 都是氧化物
都是氧化物
c. ![]() 、MgO和
、MgO和![]() 都有很高的熔点
都有很高的熔点
(4)氢氧化铝在强酸溶液中的电离方程式________。
(5)明矾常用作净水剂,结合相关理论解释其净水原理__________。
(6)用于治疗胃酸过多的药物还有多种,请写出其中一种的化学式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com