
����Ŀ��A��B��C��D��E�����ֶ���������Ԫ�أ�����A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ�B���γɻ�������������Ԫ�أ�C�ǵؿ��к�������Ԫ�أ�D����̬�⻯���ˮ��Һ�Լ��ԣ�E�����Ƴɽ�������ӹ����Ƴ�һ�ָ������ķ��⾵���ý�����ĩ����������ϳ����ں��Ӹֹ죮
(1)д��C��E��Ԫ�ط���______��______��
(2)BԪ��λ�����ڱ��е�λ��Ϊ______��BC2�ĵ���ʽΪ______(��Ԫ�ط��ű�ʾ)��
(3)A��B��C��D��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
(4)E������������Ӧ��ˮ�����������Ԫ��������������Ӧˮ���������ǿ����������Һ�з�Ӧ�����ӷ���ʽ______��
���𰸡�O Al �ڶ�����IVA�� ![]() C��N��O��H Al��OH��3+OH��=AlO2��+2H2O
C��N��O��H Al��OH��3+OH��=AlO2��+2H2O
��������
A��B��C��D��E�����ֶ���������Ԫ�أ�����A��Ԫ�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���AΪHԪ�أ�B���γɻ�������������Ԫ�أ���BΪCԪ�أ�C�ǵؿ��к�������Ԫ�أ���CΪOԪ�أ�D����̬�⻯���ˮ��Һ�Լ��ԣ���DΪNԪ�أ�E�����Ƴɽ�������ӹ����Ƴ�һ�ָ������ķ��⾵���ý�����ĩ����������ϳ����ں��Ӹֹ죬��EΪAl��
��1��CΪOԪ�ء�EΪAlԪ�أ��ʴ�Ϊ��O��Al��
��2��BΪ̼Ԫ�أ�λ�����ڱ��е�λ��Ϊ���ڶ�����IVA�壬CO2�ĵ���ʽΪ![]() ���ʴ�Ϊ���ڶ�����IVA�壻
���ʴ�Ϊ���ڶ�����IVA�壻![]() ��
��
��3������Ԫ����Hԭ�Ӱ뾶��С��ͬ�����������ԭ�Ӱ뾶��С����ԭ�Ӱ뾶��C��N��O��H���ʴ�Ϊ��C��N��O��H��
��4��E������������Ӧ��ˮ����ΪAl��OH��3��������Ԫ��������������Ӧˮ���������ǿ������ΪNaOH����������Һ�з�Ӧ�����ӷ���ʽ��Al��OH��3+OH��=AlO2��+2H2O��
�ʴ�Ϊ��Al��OH��3+OH��=AlO2��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mLijŨ�ȵ�������Һ�е���0.1 mol��L��1��ˮ����Һ��ˮ�������������Ũ������백ˮ������仯��ͼ��ʾ�����з�����ȷ����
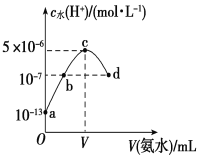
A.c����ʾ��Һ�У�c(H��)��c(OH��)��c(NH3��H2O)
B.b����ʾ��Һ�У�c(NH4��)��2 c(SO42��)
C.V��40
D.�������Ũ��Ϊ0.1 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ú̿������ȡ�л�����ԭ����Ȳ���������¡��ش��������⣺
![]()
(1)��ú̿�õ���̿�Ĺ�ҵ����Ϊ_____________��
a������ b������ c���ѻ� d���ѽ�
(2)ʵ�����õ�ʯ��CaC2�����Ʊ���Ȳ����Ӧ�Ļ�ѧ����ʽΪ��___________����Ȳ��һ��������ζ�����壬��ʵ�����Ʊ�����Ȳ��������������Ĵ̼�����ζ������ij����Һ���м��飬д�����������Ļ�ѧ����ʽ��___________
(3)��Ȳ��ʹ��ˮ��ɫ��˵����Ȳ����_____________��Ӧ����Ӧ���ͣ�����Ȳ��ʹ���Ը��������ɫ��˵����Ȳ���ױ�_____________������߷������Ծ���ȲΪ����ĸ߾��д����Ӧ��Ļ�ѧ����ʽ��_____________��
(4)��Ȳ��һ�������£����۵õ�CH2��CH��C��C��CH��CH2����д���������������ͬ��ѧʽ�Ҳ������ӳɷ�Ӧ���ʵĽṹ��ʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H3AsO3��SnCl2��Ũ�����з�Ӧ�����ӷ���ʽΪ3Sn2����2H3AsO3��6H����18Cl��=2As��3SnCl62����6M�����ڸ÷�Ӧ��˵���д������
A.MΪH2O
B.��ԭ����Sn2������ԭ������As
C.�����ԣ�H3AsO3��SnCl62��
D.ÿ����7.5 g As��ת�Ƶĵ���Ϊ0.6 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��PCl3��Ҫ��������аٳ���л���ũҩ�ͻǰ����(S.D)��ҽҩ��ԭ�ϡ���ͼΪʵ��������ȡ��PCl3��Ʒ��װ�ã��г�װ����ȥ��
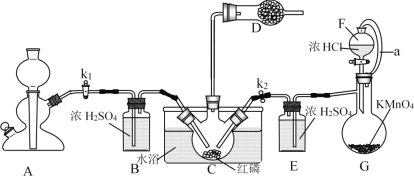
����������֪������������Cl2��Ӧ����PCl3�������Cl2��Ӧ����PCl5��PCl3��ˮ��ǿ��ˮ������H3PO3��PCl3��O2������POCl3(��������)��PCl3��POCl3���۷е���±���
���� | �۵�/�� | �е�/�� |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
�ش��������⣺
(1)����G��������______��װ��F��G����a����ͨ��a��������_______��
(2)A����ȡCO2װ�ã�CO2��������_____��ѡ��A�е�ҩƷ��_____(����ĸ)��
a.ϡ���� b.ϡ���� c.NaHCO3��ĩ d.��״ʯ��ʯ
(3)װ��D��ʢ�м�ʯ�ң���������__________________��
(4)װ��G������Cl2����Ӧ�����ӷ���ʽΪ___________��
(5)װ��C����65-70��ˮԡ���ȣ��Ƶõ�PCl3�ֲ�Ʒ�г�����POCl3��PCl5�����ʣ����ӵķ����ǣ��ȼ�������ȣ���ȥPCl5��Ȼ��ͨ��___________(��ʵ���������)�����ɵõ��ϴ�����PCl3��
(6)ͨ��ʵ��ⶨ�ֲ�Ʒ��PCl3������������ʵ�鲽������(���������ʵķ�Ӧ)��
��һ����Ѹ����ȡ20.0 g PCl3�ֲ�Ʒ����ˮ��ȫˮ��������500mL��Һ��
�ڶ�������ȡ25.00mL��Һ������ƿ�У�
������������0. 5molL��1����Һ20mL���������H3PO3��ȫ��Ӧ����H3PO4��
���IJ������뼸�ε�����Һ����1.0 molL��1Na2S2O3����Һ�ζ������ĵ⣬��Ӧ����ʽΪI2+2Na2S2O3=Na2S4O6+2NaI�������յ�ʱ����Na2S2O3����Һ12mL��
�ٵ������з�Ӧ�Ļ�ѧ����ʽΪ_____________��
�ڸ����������ݣ�����ò�Ʒ��PCl3����������Ϊ______%��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.78��þ���Ļ����Ͷ�뵽25mL30.625%ϡ����(�ܶ�Ϊ1.28g/cm3)�У���ַ�Ӧ���ڱ�״̬�µõ��������0.896L(���������ȫ���ռ�)���ڷ�Ӧ�����Һ�м���4mol/L NaOH��Һ��ʹþ������ȫ�����������ӳ�����ȫ��ʧ��ͨ������ش��������⣺
(1)ϡ��������ʵ���Ũ��Ϊ______mol/L
(2)���������������Ϊ______��
(3)��Ӧ����Һ�м���4mol/L NaOH��Һ���������Ϊ���ٺ�������ʹ����������������þ�����ֿ���______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�������ͼ��ʾװ����ȡ�϶���������������֪������ˮ�Ȼ��ƿ����Ҵ��γ�������ˮ��CaCl2��6C2H5OH��
���й��л���ķе㣺
�Լ� | ���� | �Ҵ� | ���� | �������� |
�е㣨�棩 | 34.7 | 78.5 | 118 | 77.1 |
����˵����ȷ����
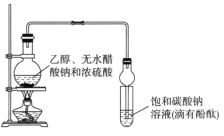
A.װ�������ιܼ��������������ܷ�ֹ����
B.��Ӧ��������Թ��е������ǣ���Һ�ֲ㣬�²���ɫ��״Һ�壻�ϲ���Һ��ɫ��dz
C.�Ӵ��Թ��з���������������л�����һ�������Ҵ������Ѻ�ˮ��Ӧ�ȼ�����ˮ�Ȼ��ƣ����˷�����Ҵ�
D.��������ˮ�����ƣ�Ȼ����������ռ�118�����ҵ���֣��Եõ��ϴ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��Ԫ�����ڱ���ǰ36��Ԫ�أ����ǵĺ˵�����������ڶ�����Ԫ��Aԭ�ӵĺ���ɶԵ�������δ�ɶԵ�������2������3���ܼ���Bԭ�ӵ������p����ĵ���Ϊ������ṹ��C�ǵؿ��к�������Ԫ�ء�D�ǵ�������Ԫ�أ���ԭ�Ӻ�����������������ԭ����ͬ�����������Ӿ���������ش��������⣺
(1)A��B��C�ĵ�һ��������С�����˳����________(�ö�Ӧ��Ԫ�ط��ű�ʾ)����̬Dԭ�ӵļ۵����Ų�ʽΪ______________________��
(2)A���������������У�������ԭ�Ӳ�ȡ________�ӻ���BC3-�����幹��Ϊ________(����������)��
(3)1 mol AB-�к��е���������Ϊ________��
(4)������CH3COO[Cu(NH3)3��CO]����Cu���γ������ӵ�����Ϊ____________(�ѧʽ)��
(5) CH3COOH��Cԭ���ӻ��������Ϊ_________________��
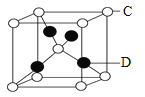
(6)Ԫ��D��Ԫ��C�γ�һ�ֻ������侧���ṹ��ͼ��ʾ���û�����Ļ�ѧʽΪ______.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ������Ȼ�������о�����ȡ�����½�չ����ԭ����ͼ��ʾ�������й�˵��������ǣ� ��
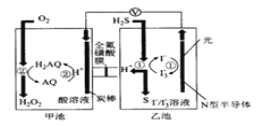
A.ͼ�е����ϱ�Ƿ���Ϊ��������
B.װ����H+��׳�Ǩ��
C.�����ϵĵ缫��ӦʽΪO2+4H++4e��=2H2O
D.�ҳ���Һ�з�����Ӧ�����ӷ���ʽ��H2S+I3�� =3I��+S��+2H+
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com