
【题目】功能高分子P的合成路线如下:
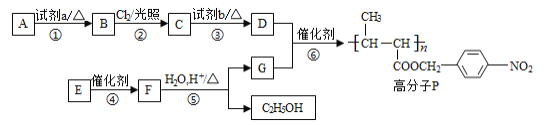
(1)A的分子式是C7H8,其结构简式是________。
(2)试剂a是_______。
(3)反应③的化学方程式:________。
(4)E的分子式是C6H10O2。E中含有的官能团:_________。
(5)反应④的反应类型是________。
(6)反应⑤的化学方程式:________。
(7)已知:2CH3CHO ![]() 。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
。以乙烯为起始原料,选用必要的无机试剂合成E,合成路线如下,写出 I,J 的结构简式:________、________
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() (I)
(I)![]()
![]()
![]()
![]()
![]() (J)
(J)![]() E
E
【答案】![]() 浓硫酸和浓硝酸
浓硫酸和浓硝酸 ![]() +NaOH
+NaOH![]()
![]() +NaCl 碳碳双键、酯基 加聚反应
+NaCl 碳碳双键、酯基 加聚反应  +nH2O
+nH2O![]()
 +nC2H5OH CH3CH(OH)CH2CHO CH3CH=CHCHO
+nC2H5OH CH3CH(OH)CH2CHO CH3CH=CHCHO
【解析】
P为高分子化合物,D+G→P反应类型为取代反应或酯化反应,生成P的反应物是 和
和![]() ,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为
,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为![]() ,A→B应在甲基对位上引入-NO2,即B的结构简式为
,A→B应在甲基对位上引入-NO2,即B的结构简式为![]() ,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为
,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为 ,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为
,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为![]() ,G为
,G为 ,反应⑤发生水解,则F的结构简式为
,反应⑤发生水解,则F的结构简式为 ,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,据此分析;
,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,据此分析;
P为高分子化合物,D+G→P反应类型为取代反应或酯化反应,生成P的反应物是 和
和![]() ,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为
,根据流程以及A的分子式为C7H8,推出A为甲苯,即结构简式为![]() ,A→B应在甲基对位上引入-NO2,即B的结构简式为
,A→B应在甲基对位上引入-NO2,即B的结构简式为![]() ,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为
,B→C在光照下,B与氯气发生取代反应,Cl取代甲基上的H原子,即C的结构简式为 ,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为
,C应在氢氧化钠的水溶液中发生水解反应,生成D,即D的结构简式为![]() ,G为
,G为 ,反应⑤发生水解,则F的结构简式为
,反应⑤发生水解,则F的结构简式为 ,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,
,E分子式为C6H10O2,则E的结构简式为CH3CH=CH-COOC2H5,
(1)A的分子式为C7H8,根据上述分析,A为甲苯,其结构简式为![]() ;
;
(2)根据上述分析,A→ B引入-NO2,则试剂a为浓硫酸和浓硝酸;
(3)根据上述分析,反应③发生水解反应,即反应方程式为![]() +NaOH
+NaOH![]()
![]() +NaCl;
+NaCl;
(4)E的结构简式为CH3CH=CH-COOC2H5,含有的官能团是碳碳双键和酯基;
(5)根据E和F的结构简式,推出反应④的类型为加聚反应;
(6)反应⑤发生酯的水解,其反应方程式为 +nH2O
+nH2O![]()
 +nC2H5OH;
+nC2H5OH;
(7)根据合成路线,以及已知信息,则I的结构简式为CH3CH(OH)CH2CHO,生成J条件是浓硫酸加热,发生消去反应,即J的结构简式为CH3CH=CHCOOH。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )
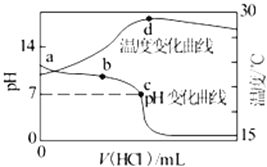
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点时c(NH4+)+c(NH3·H2O)>c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)=20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用浓氨水和生石灰制取氨气,并探究氨气的性质,其装置如图所示,下列说法错误的是
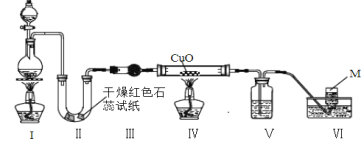
A.一段时间后,Ⅱ中干燥红色石蕊试纸变蓝色
B.Ⅲ干燥管中盛放的试剂可以是无水氯化钙
C.Ⅳ中黑色粉末逐渐变为红色说明氨气具有还原性
D.实验结束后,应先将导气管从水槽中拿出再熄灭酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸里,待合金完全溶解后,往溶液里加入1mol/L NaOH溶液,生成的物质的量随加入NaOH溶液体积的变化如下图A所示。则有关说法中不正确的是

A.a的取值范围为0a<50
B.![]() 的最大值为2.5
的最大值为2.5
C.若将关系图改为B图时,则a的取值范围为80<a<90
D.若将关系图改为C图时,则a的取值范围为75<a<90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及氮的化合物有着重要的用途。
(1)氮元素在周期表中的位置是______; NH3的电子式是______。
(2)将空气中游离态的氮转化为含氮化合物的过程叫氮的固定,请举例说明一种自然界中氮的固定的途径______ (用化学方程式表示)。
(3)工业合成氨是人工固氮的重要方法。2007年化学家格哈德埃特尔证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下图:
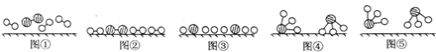
下列说法正确的是______(选填字母)。
a 图①表示N2、H2分子中均是单键
b 图②→图③需要吸收能量
c 该过程表示了化学变化中包含旧化学键的断裂和新化学键的生成
(4)已知:N2(g)+3H2(g)=2NH3(g) △H= -92.4 kJ/mol,2H2(g)+O2(g)=2H2O(g) △H = -483.6kJ/mol,则氨气作燃料完全燃烧生成氮气和水蒸气的热化学方程式是________。
(5)水合肼(N2H4H2O)为无色透明的油状发烟液体,是一种重要的精细化工原料,通常在催化剂存在下,用次氯酸钠与氨反应可制备,该反应的化学方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由煤炭出发制取有机化工原料乙炔,流程如下。回答以下问题:
![]()
(1)由煤炭得到焦炭的工业操作为_____________。
a.分馏 b.干馏 c.裂化 d.裂解
(2)实验室用电石(CaC2)来制备乙炔,反应的化学方程式为:___________。乙炔是一种稍有气味的气体,但实验室制备的乙炔气体具有令人厌恶的刺激性气味,可用某种溶液进行检验,写出检验此气体的化学方程式:___________
(3)乙炔能使溴水褪色,说明乙炔发生_____________反应(反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被_____________。导电高分子是以聚乙炔为载体的高聚物,写出反应Ⅱ的化学方程式:_____________。
(4)乙炔在一定条件下,三聚得到CH2﹦CH—C≡C—CH﹦CH2:,写出该三聚物具有相同化学式且不易发生加成反应物质的结构简式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,海水中的元素共含有80多种,总储量很大。常量元素包括H、B、C、O、F、Na、Mg、S、Cl、K、Ca、Br、Sr等13种元素,同时还含有Cr、Mn、Fe、Ni、Cu、Zn等微量元素,因此开发利用海水资源具有非常广阔的前景。
(1)上述涉及到的元素中,不属于前四周期的是___,基态原子中的未成对电子数最多是___(写元素符号)。
(2)基态Fe3+的价电子排布式___,基态B原子的电子排布图为___。
(3)B、C、O、F四种元素基态原子第一电离能由大到小的顺序为___(写元素符号)。
(4)CO32-的中心原子价层电子对数为___对,SO32-的空间构型为___,HCHO中C的杂化方式为___。
(5)氨气极易溶于水的主要原因之一为NH3与H2O分子之间可以形成氢键,氨水中存在的氢键有___种。
(6)干冰与水晶熔化需破坏的主要作用分别是___、___。
(7)已知钠的密度为ag/cm3,NA为阿伏加德罗常数的值,钠的晶胞结构如图,则晶胞棱长为___ pm。
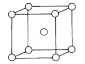
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3主要用于制造敌百虫等有机磷农药和磺胺嘧啶(S.D)等医药的原料。如图为实验室中制取粗PCl3产品的装置,夹持装置略去。
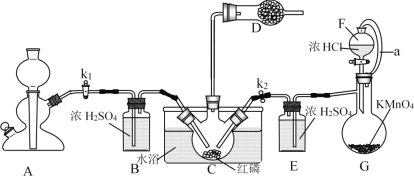
经查阅资料知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇水会强烈水解生成H3PO3。PCl3遇O2会生成POCl3(三氯氧磷),PCl3、POCl3的熔沸点见下表。
物质 | 熔点/℃ | 沸点/℃ |
PCl3 | -112 | 75.5 |
POCl3 | 2 | 105.3 |
回答下列问题:
(1)仪器G的名称是______。装置F与G由橡胶管a相连通,a的作用是_______。
(2)A是制取CO2装置,CO2的作用是_____,选择A中的药品是_____(填字母)。
a.稀盐酸 b.稀硫酸 c.NaHCO3粉末 d.块状石灰石
(3)装置D中盛有碱石灰,其作用是__________________。
(4)装置G中生成Cl2,反应的离子方程式为___________。
(5)装置C采用65-70℃水浴加热,制得的PCl3粗产品中常含有POCl3、PCl5等杂质,除杂的方法是:先加入红磷加热,除去PCl5,然后通过___________(填实验操作名称),即可得到较纯净的PCl3。
(6)通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
第一步:迅速移取20.0 g PCl3粗产品,加水完全水解后,再配成500mL溶液;
第二步:移取25.00mL溶液置于锥形瓶中;
第三步:加入0. 5molL-1碘溶液20mL,碘过量,H3PO3完全反应生成H3PO4;
第四步:加入几滴淀粉溶液,用1.0 molL-1Na2S2O3标准溶液滴定过量的碘,反应方程式为I2+2Na2S2O3=Na2S4O6+2NaI,滴至终点时消耗Na2S2O3标准溶液12mL。
①第三步中反应的化学方程式为_____________。
②根据上述数据,计算该产品中PCl3的质量分数为______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
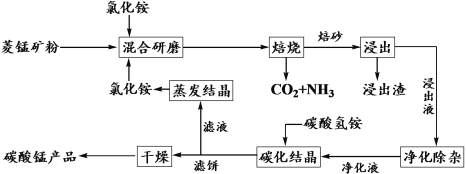
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时主要反应的化学方程式为__________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:_________________。

(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全。
(4)碳化结晶时,发生反应的离子方程式为___________,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(5)流程中能循环利用的固态物质是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com