
【题目】甲酸溶液的pH=6,乙酸溶液的pH=2,则下列叙述正确的是
A.甲、乙两溶液的c(H+)之比为400∶1
B.甲、乙两溶液均呈酸性
C.甲中水的电离程度大于乙中水的电离程度
D.甲、乙两溶液等体积混合后溶液的pH=4
科目:高中化学 来源: 题型:
【题目】北京航空航天大学教授偶然中发现米虫吃塑料,受此启发进行了系列实验,证实黄粉虫的肠道微生物可降解聚苯乙烯(PS),蜡虫可降解聚乙烯(PE)。聚苯乙烯在虫肠内降解的示意图如下,下列说法正确的是
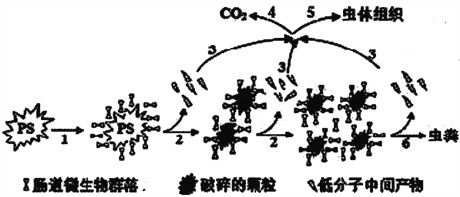
A. 在虫肠内微生物作用下,聚苯乙烯断裂碳碳双键
B. 在虫肠内微生物作用下,聚苯乙烯直接降解为CO2分子
C. 在虫肠内微生物作用下,聚苯乙烯发生降解,分子量降低
D. 聚乙烯与聚苯乙烯是同系物,具有烯烃的性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①![]() 分子中S原子采用的轨道杂化方式
分子中S原子采用的轨道杂化方式![]()
②![]() 分子中只有以s轨道与
分子中只有以s轨道与![]() 杂化轨道“头碰头”方式重叠而成的
杂化轨道“头碰头”方式重叠而成的![]() 键
键
③![]() 分子中
分子中![]() 的键角
的键角![]()
④![]() 中
中![]() 键角比
键角比![]() 中
中![]() 键角大.
键角大.
A.①②B.③④C.①②③D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示,下列说法正确的是
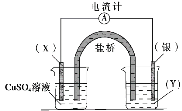
A.电极X可以是碳棒也可以是银棒
B.盐桥中的阳离子流向CuSO4溶液所在烧杯
C.银电极为电池的负极,发生的电极反应为Ag-e-=Ag+
D.外电路中电流的方向是从银电极流向X电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,合成硫酰氯的实验装置如下图:
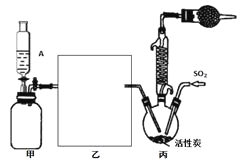
已知:①SO2(g)+Cl2(g)SO2Cl2(g) H=-97.3kJ/mol;
②硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲为储气装置,用于提供氯气,则仪器A中盛放的试剂为______________。装置丙中活性炭的作用是______________。
(2)在上图方框内所缺装置为洗气瓶,瓶内应装的试剂是______________________。
(3)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为_______,分离产物的方法是(填字母)____。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________(填序号)。
①先通冷凝水,再通气 ②控制气流速率,宜慢不宜快
③若三颈烧瓶发烫,可适当降温 ④加热三颈烧瓶
(5)在无活性炭存在的条件下SO2与Cl2也可发生反应,现将SO2、Cl2按照一定比例通入水中,请设计一个简单实验验证二者是否恰好完全反应:__________(简要描述实验步骤、现象和结论)。仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、碘化钾溶液、淀粉溶液、品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO的制备原理:HCOOH![]() CO↑+H2O.(常温下甲酸为液体)
CO↑+H2O.(常温下甲酸为液体)
(1)原料气CH3CH=CH2、CO和H2的制备均可用图1装置:
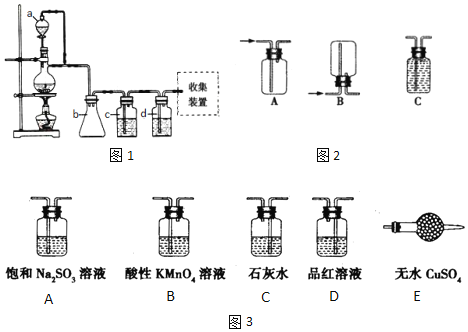
填写下列空白:
①若用上述装置制备氢气,收集装置可选用图2下列______装置
②若用上述装置制备干燥纯净的CO气体,装置b的作用是______;c中盛装的试剂是______。
为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是______。
③实验室用浓硫酸和2-丙醇制备丙烯时,还产生少量SO2、CO2及水蒸气,该小组用图3试剂检验这四种气体,混合气体通过试剂的顺序是______(填序号,试剂可以重复使用);写出2-丙醇与浓硫酸反应生成SO2、CO2及水蒸气的化学方程式______;
(2)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______。
a.低温、高压、催化剂b.适当的温度、高压、催化剂
c.常温、常压、催化剂d.适当的温度、常压、催化剂
(3)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如图提纯路线:
![]()
试剂1为______,操作3为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有浓度均为0.5 mol·L-1的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
(1)上述溶液中,溶质可发生水解的是_______________(填序号)。
(2)上述既能与氢氧化钠反应,又能和硫酸反应的溶液中,离子浓度由大到小的顺序为_____。
(3)向④中加入少量氯化铵固体,此时溶液中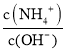 的值____________ (填“增大”、“减小”或“不变”)。
的值____________ (填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是_____________。
(5)取10 mL③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个容积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为_________________
(2)反应开始至2 min,气体Z的平均反应速率为___________。
(3)若X、Y、Z均为气体,反应达到平衡时
①压强是开始时的_________倍;
②若此时将容器的体积缩小为原来的![]() 倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为_________(填“放热”或“吸热”)反应。
倍,达到平衡时,容器内温度将升高(容器不与外界进行热交换),则该反应的正反应为_________(填“放热”或“吸热”)反应。
(4) 25°C时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。请回答如下问题

①曲线_________(填“Ⅰ”或“Ⅱ”)代表盐酸的稀释过程
②a溶液的导电性比c溶液的导电性_________(填“强”或“弱”)
③将a、b两溶液加热至30°C,c(Cl-)/c(CH3COO-)_________(填“变大”、“变小”或“不变”)
④设稀释前的醋酸电离度为0.1%,醋酸的电离常数Ka=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiCl3是烯烃定向聚合的催化剂、TiCl4可用于制备金属Ti。
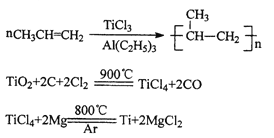
(1)Ti3+的基态核外电子排布式为__________
(2)丙烯分子中,碳原子轨道杂化类型为__________
(3)Mg、Al、Cl第一电离能由大到小的顺序是___________
(4)写出一种由第2周期元素组成的且与CO互为等电子体的阴离子的电子式________
(5)TiCl3浓溶液中加入无水乙醚,并通入HCl至饱和,在乙醚层得到绿色的异构体,结构式分别是[Ti(H2O)6]Cl3、[Ti(H2O)5Cl]Cl2·H2O。1mol[Ti(H2O)6]Cl3中含有σ键的数目为______.
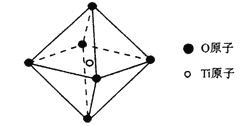
(6)钛酸锶具有超导性、热敏性及光敏性等优点,该晶体的晶胞中Sr位于晶胞的顶点,O位于晶胞的面心,Ti原子填充在O原子构成的正八面体空隙的中心位置,据此推测,钛酸锶的化学式为_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com