
【题目】某化学兴趣小组为合成1-丁醇,查阅资料得知如下合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO![]() CH3CH2CH2CH2OH
CH3CH2CH2CH2OH
已知:CO的制备原理:HCOOH![]() CO↑+H2O.(常温下甲酸为液体)
CO↑+H2O.(常温下甲酸为液体)
(1)原料气CH3CH=CH2、CO和H2的制备均可用图1装置:
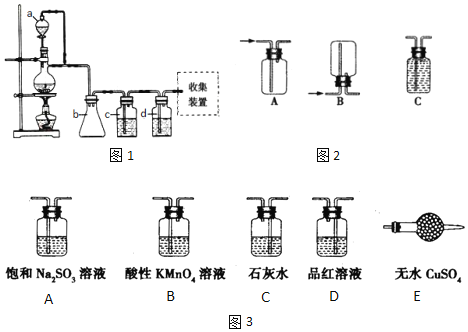
填写下列空白:
①若用上述装置制备氢气,收集装置可选用图2下列______装置
②若用上述装置制备干燥纯净的CO气体,装置b的作用是______;c中盛装的试剂是______。
为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是______。
③实验室用浓硫酸和2-丙醇制备丙烯时,还产生少量SO2、CO2及水蒸气,该小组用图3试剂检验这四种气体,混合气体通过试剂的顺序是______(填序号,试剂可以重复使用);写出2-丙醇与浓硫酸反应生成SO2、CO2及水蒸气的化学方程式______;
(2)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是______。
a.低温、高压、催化剂b.适当的温度、高压、催化剂
c.常温、常压、催化剂d.适当的温度、常压、催化剂
(3)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;
②沸点:乙醚34℃,1-丁醇118℃,并设计出如图提纯路线:
![]()
试剂1为______,操作3为______。
【答案】BC 防倒吸,安全瓶作用 NaOH溶液 HCOOH EDADCB CH3CH2OH+9H2SO4![]() 13H2O+9SO2↑+3CO2↑ b 饱和NaHSO3溶液 蒸馏
13H2O+9SO2↑+3CO2↑ b 饱和NaHSO3溶液 蒸馏
【解析】
根据实验原理、合成路线图及实验装置图分析选择正确实验装置并分析装置作用;根据物质性质书写相关反应方程式;根据影响反应速率的因素选择适合的反应条件;根据物质提纯和分离方法及路线图分析解答。
(1)①因为氢气不溶于水,密度比空气小,可以用排水法或向下排空气法收集,装置B或C符合题意,故答案为:BC;
②因为甲酸易溶于水,所以必须防止液体倒流,即b的作用是防止倒吸;甲酸在浓硫酸的作用下通过加热脱水即生成CO,由于甲酸易挥发,产生的CO中必然会混有甲酸,所以在收集之前需要除去甲酸,可以利用NaOH溶液吸收甲酸,CO 的制备原理:HCOOH ![]() CO↑+H2O。(常温下甲酸为液体)甲酸为反应物,浓硫酸为催化剂,为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是HCOOH,故答案为:防倒吸,安全瓶作用; NaOH溶液;HCOOH;
CO↑+H2O。(常温下甲酸为液体)甲酸为反应物,浓硫酸为催化剂,为了控制生成一氧化碳的速度,则分液漏斗a中盛装的试剂是HCOOH,故答案为:防倒吸,安全瓶作用; NaOH溶液;HCOOH;
③检验丙烯可以用酸性KMnO4溶液,检验SO2可以用酸性KMnO4溶液褪色、品红溶液或石灰水,检验CO2可以石灰水,检验水蒸气可以无水CuSO4,所以在检验这四种气体必须考虑试剂的选择和顺序。只要通过溶液,就会产生水蒸气,因此先检验水蒸气;然后检验SO2并在检验之后除去SO2,除SO2可以用饱和Na2SO3溶液,用品红溶液检验SO2是否除尽,最后检验CO2和丙烯,用石灰水检验CO2,再用酸性KMnO4溶液检验丙烯,则装置按气流方向的连接顺序为:EDADCB,浓硫酸具有强氧化性,能将乙醇氧化,反应方程式为:CH3CH2OH+9H2SO4![]() 13H2O+9SO2↑+3CO2↑,故答案为:EDADCB;CH3CH2OH+9H2SO4
13H2O+9SO2↑+3CO2↑,故答案为:EDADCB;CH3CH2OH+9H2SO4![]() 13H2O+9SO2↑+3CO2↑;
13H2O+9SO2↑+3CO2↑;
(2)由于反应是一个体积减小的可逆反应,所以采用高压,有利于增大反应速率和提高原料气的转化率,正向反应是放热反应,虽然低温有利于提高原料气的转化率,但不利于增大反应速率,因此要采用适当的温度,催化剂不能提高原料气的转化率,但有利于增大反应速率,缩短到达平衡所需要的时间,故正确所选项是b;故答案为:b;
(3)粗品中含有正丁醛,根据所给的信息利用饱和NaHSO3溶液形成沉淀,然后通过过滤即可除去;由于饱和NaHSO3溶液是过量的,所以加入乙醚的目的是萃取溶液中的1-丁醇。因为1-丁醇和乙醚的沸点相差很大,因此可以利用蒸馏将其分离开,故答案为:饱和NaHSO3溶液;蒸馏。


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
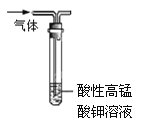
A.用如图装置除去乙烷中混有的乙烯
B.配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏大
C.制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
D.玻璃仪器洗涤干净的标准是:附着在仪器内壁上的水既不聚集成滴,也不成股流下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯,反应装置如图。下列对该实验的叙述错误的是

A.长玻璃管起冷凝回流作用
B.水浴加热其优点是受热均匀,便于控制温度
C.粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤
D.洗涤后,用无水CaCl2干燥,然后过滤,得到纯硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在电离平衡NH3·H2O ![]() NH4++OH-,下列叙述正确的是
NH4++OH-,下列叙述正确的是
A.加水稀释后,溶液中c (H+)减小
B.通入少量HCl(g)后,溶液中c(NH4+)减小
C.加入少量浓氨水,电离平衡逆向移动
D.加入少量NH4Cl固体,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸溶液的pH=6,乙酸溶液的pH=2,则下列叙述正确的是
A.甲、乙两溶液的c(H+)之比为400∶1
B.甲、乙两溶液均呈酸性
C.甲中水的电离程度大于乙中水的电离程度
D.甲、乙两溶液等体积混合后溶液的pH=4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机反应类型的以下判断不正确的是
选项 | 有机反应 | 反应类型 |
A | 苯与H2反应生成环己烷 | 加成反应 |
B | 甲烷与氯气混合光照爆炸 | 取代反应 |
C | 乙烯与溴的CCl4溶液反应 | 取代反应 |
D | 乙烯使酸性高锰酸钾溶液褪色 | 氧化反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在一个2 L的恒容密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
A. 平衡时,v(A)∶v(B)∶v(C)∶v(D) =4∶3∶2∶1
B. 混合气的平均相对分子质量可作为平衡标志
C. 充入惰性气体使压强增大可加快反应速率
D. C的平均反应速率为0.5 mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物ZYX4是在化工领域有着重要应用价值的离子化合物,电子式如图所示。X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为金属元素,X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )

A.Z是短周期元素中金属性最强的元素
B.Y的最高价氧化物对应水化物呈弱酸性
C.X、Y可以形成分子式为YX3的稳定化合物
D.化合物ZYX4有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJmol-1
B. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 已知中和热为△H=-57.4kJmol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com