
【题目】一定温度下在一个2 L的恒容密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min达平衡状态,此时B反应消耗了0.9 mol,下列说法正确的是
A. 平衡时,v(A)∶v(B)∶v(C)∶v(D) =4∶3∶2∶1
B. 混合气的平均相对分子质量可作为平衡标志
C. 充入惰性气体使压强增大可加快反应速率
D. C的平均反应速率为0.5 mol/(L·min)
科目:高中化学 来源: 题型:
【题目】有机物J 是我国自主成功研发的一类新药,它属于酯类,分子中除苯环外还含有一个五元环。合成J的一种路线如下:
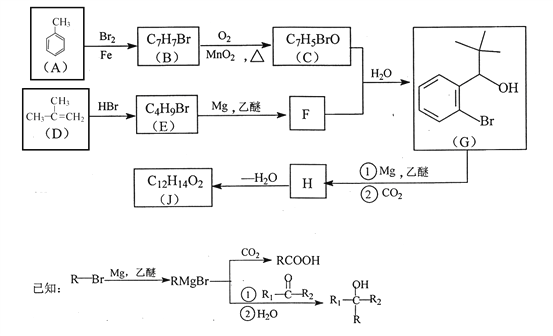
回答下列问题:
(1)B的结构简式是________________。C的结构简式是______________。
(2)D生成 E的化学方程式为_________________。
(3)J的结构简式是________________。在一定条件下,H自身缩聚生成高分子化合物的结构简式是_______________。
(4)根据![]() ,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
,X的分子式为______。X有多种同分异构体,其中满足下列条件的同分异构体共有______种(已知:碳碳叁键或碳碳双键不能与羟基直接相连)。
A.除苯环外无其他环,且无一O—O—键
B.能与FeCl3溶液发生显色反应
C.苯环上一氯代物只有两种
(5)利用题中信息和所学知识,写出以甲烷和甲苯 为原料,合成![]() 的路线流程图(其它试剂自选):____________________________。
的路线流程图(其它试剂自选):____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 在一定条件下,可逆反应A+B![]() mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况。

(1)温度T1________T2(填“大于”“等于”或“小于”)。
(2)正反应是________反应(填“吸热”或“放热”)。
(3)如果A、B、C均为气体,则m________2(填“大于”“等于”或“小于”)。
(4)当温度和容积不变时,如在平衡体系中加入一定量的某稀有气体,则体系的压强________(填“增大”“减小”或“不变”),平衡_________________移动(填“向正反应方向”“向逆反应方向”或“不”)。
II. CO是生产羰基化学品的基本原料, 850℃时,在恒容密闭容器中通入CO和H2O(g),发生:CO(g)+H2O(g) ![]() H2(g)+CO2(g)
H2(g)+CO2(g) ![]() H<0,测定浓度随时间关系如下表:
H<0,测定浓度随时间关系如下表:
t/min | c(CO)/ mol·L-1 | c(H2O)/ mol·L-1 |
0 | 0.30 | 0.20 |
2 | \ | 0.10 |
3 | 0.18 | \ |
4 | \ | 0.08 |
回答下列问题
(1)t=3min时,υ(正)____________υ(逆)(选填:“>”,“<”,“=”)。
(2)0~2min,CO的平均反应速率为 ____________。
(3)上述反应中的CO平衡转化率为____________。
(4)在一定条件下,发生下列反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。
H2(g)+CO2(g),其逆反应的速率随时间变化曲线如图所示,则t1时改变的某种反应条件可能是_____(填序号)。

a.增大CO浓度
b.加压
c.恒容时充入氩气
d.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是

A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.工业上常用电解法制备单质b
D.a和b形成的化合物不可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是![]()
![]()
A. ![]() 、
、![]() 、
、![]() 中,所有原子都满足最外层8电子的稳定结构
中,所有原子都满足最外层8电子的稳定结构
B. 在元素周期表中金属和非金属交界处可以找到半导体材料
C. 由非金属元素组成的化合物一定是共价化合物
D. 第ⅠA族元素和第ⅦA族元素的原子之间都能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与11.2 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为
A. 32 g B. 48 g C. 64 g D. 96 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图象如图所示(不考虑C2O42-的水解)。下列叙述正确的是
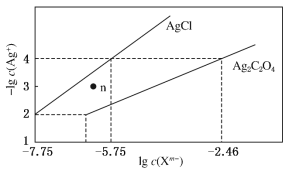
A. Ksp(Ag2C2O4)的数量级等于10-7
B. n点表示AgCl的不饱和溶液
C. 向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D. Ag2C2O4(s)+2Cl-(aq)![]() 2AgCl(s)+C2O42-(aq)的平衡常数为109.04
2AgCl(s)+C2O42-(aq)的平衡常数为109.04
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.0 gCu投入50mL 12moL/L的浓硝酸中,充分反应后,收集到4.48L(标准状况)NO和NO2的混合气体。
(1)被还原硝酸的物质的量是_________mol。
(2)判断32.0gCu和50mL 12moL/L的硝酸反应后有剩余的是______________,剩余的物质物质的量为____________________,生成的NO气体体积为(标况下)_________________。
(3)如果往反应后的体系内再加入100mL2mol/L的稀硫酸,充分反应后又有气体逸出。写出反应的离子方程式并用单线桥法表示电子转移的方向和数目 _______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)的最重要用途是作为铁合金的添加剂,用CO还原MoO3制备单质Mo的装置如图所示(尾气处理装置已省略)。下列说法正确的是

A.装置①用于制备CO2,其中石灰石可用纯碱替代
B.装置②中盛有饱和碳酸钠溶液,以除去CO2中的HCl气体
C.在装置④中生成了钼单质
D.装置⑥中的现象不能达到检验MoO3是否被CO还原的目的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com