
【题目】中和相同体积相同pH值的Ba(OH)2,NaOH和NH3H2O三种稀溶液所用相同浓度盐酸的体积分别是V1,V2,V3,它们的关系是 ( )
A. V3>V2>V1 B. V3>V2=V1 C. V3=V2>V1 D. V1=V2>V3
科目:高中化学 来源: 题型:
【题目】下图为几种晶体或晶胞的示意图:
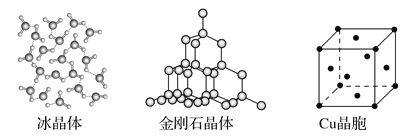
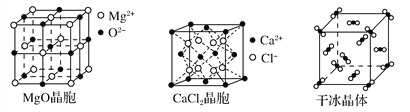
请回答下列问题:
(1)上述晶体中,粒子之间以共价键结合形成的晶体是________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为________________________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能______(填“大于”或“小于”)MgO晶体,原因是________________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰,除H2O是极性分子、CO2是非极性分子外,还有一个重要的原因是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知高能锂离子电池的总反应式为2Li+FeS=Fe+Li2S,LiPF6·SO(CH3)2为电解质,用该电池为电源电解含镍酸性废水并得到单质Ni的实验装置如图所示。下列说法不正确的是

A. 电极Y为Li
B. 电解过程中,b中NaCl溶液的物质的量浓度将不断减小
C. X极反应式为FeS+2Li++2e-=Fe+Li2S
D. 若将图中阳离子膜去掉,将a、b两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由白磷(P4:易自燃,熔点44℃,沸点280℃,有剧毒,保存在冷水中)制备六偏磷酸钠的方法如下:
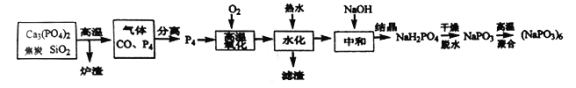
(1)“炉渣”的主要成分是___________(写化学式),该过程中氧化剂与还原剂的物质的量之比是_______________。
(2)从混合气体中分离得到P4的最佳方法是_________________。
(3)经分析“滤渣”是由白磷中的Pb、As杂质元素所形成的两种盐类,其中一种是Pb3(PO4)2,则另一种是_______________ (写化学式)。
(4)若直接将白磷与足量浓NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体。写出该化学方程式____________________。
(5)已知磷酸中含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液pH的关系如图所示,则“中和”过程中应加入NaOH调节溶液的pH值为________________。若pH过低,则造成的结果是_________________。
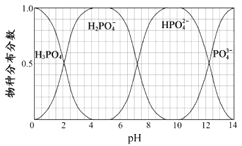
(6)经定量分析,毎100.00g产品的有效磷(以P2O5计)含量是66.50g (其它杂质为非磷酸盐成分),则该产品的纯度是__________________。(已知:NaPO3的相对分子质量为M1,P2O5的相对分子质量为M2,结果不必化简,列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NH4Cl、MgSO4、(NH4)2SO4 和NaCl四种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是
A. NaOH B. Ba(OH)2 C. AgNO3 D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于原电池和电解池的叙述正确的是( )
A. 原电池中失去电子的电极为阴极
B. 原电池的负极、电解池的阳极都发生氧化反应
C. 原电池的两极一定是由活动性不同的两种金属组成
D. 电解时电解池的阴极一定是阴离子放电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下说法中正确的是( )
A.△H<0的反应均是自发反应
B.自发进行的反应一定能迅速进行
C.冰在室温下自动熔化成水,是熵增加的结果
D.高锰酸钾加热分解是一个熵减小的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属的叙述中,正确的是
A. 金属钠着火时,可用水或泡沫灭火器灭火
B. 碱金属单质都可保存在煤油中
C. 钠离子核外电子数比钠原子核外电子数少
D. 碱金属中密度最小、熔沸点最高的是铯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)与16g氧气所含原子总数相同的氨气是_____________g;在相同条件下,在5.6g氮气中应添加___________g氨气所组成的混合气体与16g氧气所占的体积相等。
(2)把__________g NaOH溶解在90g水中,才能使得每10个水分子中有1个Na+。
(3)质量之比为16∶7∶6的三种气体SO2、CO、NO,氧原子个数之比为________。
(4)某气体氧化物的化学式为RO2,在标准状况下,0.92g该氧化物的体积为448mL,则该氧化物的摩尔质量为________。
(5)8.5g氢氧根离子含有的电子数目为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com