
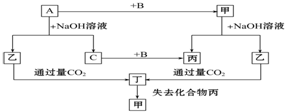
 已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答:
已知单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系,甲是一种高熔点的物质.丙常温下是一种液体.根据图示转化关系回答: ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、Fe2+、Cl-、NO3-、Na+、Al3+ |
| B、Mg2+、Ba2+、SO42-、Cl-、Al3+ |
| C、H+、Cl-、SO42-、K+、Al3+ |
| D、Na+、K+、SO42-、OH-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、M的分子式为C6H12O6 |
| B、N的结构简式为CH3COOH |
| C、M可以发生水解反应 |
| D、乙酸乙酯和N均能和NaOH溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
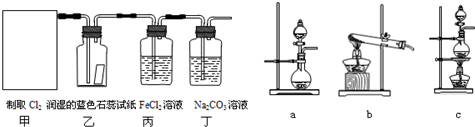
| A、用铜和稀硝酸反应制NO |
| B、用铜和浓硝酸反应制NO2 |
| C、用NH4Cl与浓NaOH溶液反应制NH3 |
| D、加热NaHCO3制CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
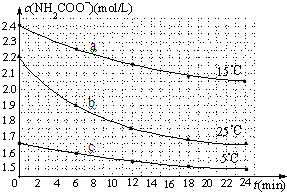 某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.
某研究小组在实验室探究氨基甲酸铵(H2NCOONH4)水解反应速率的测定和分解反应平衡常数.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去苯中苯酚,加入溴水后过滤 |
| B、分离苯和溴苯,加水后分液 |
| C、除去乙酸乙酯中乙酸,加入饱和NaOH溶液,振荡静置后分液 |
| D、区别乙酸、乙醛、乙醇,加入Cu(OH)2悬浊液加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、多肽、油脂、纤维素、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
| B、棉、麻、蚕丝、羊毛及合成纤维完全燃烧都只生成CO2和H2O |
| C、蛋白质是结构复杂的高分子化合物,蛋白质分子中都含有C、H、O、N四种元素 |
| D、根据分散质粒子的直径大小,分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液与胶体之间 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com