
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2 的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4 的 |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是碳酸钾 |
D | 将碳酸氢铵受热分解产生的气体通入某溶液 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是氢氧化钙溶液 |
A. AB. BC. CD. D
【答案】A
【解析】
A.二氧化氮为红棕色气体,温度高,颜色深,则2NO2N2O4为放热反应;B.少量的溴水分别滴入FeCl2溶液、NaI溶液中,分别反应生成铁离子、碘单质,不能比较亚铁离子、碘离子的还原性;C.白色沉淀为碳酸钙,气体为二氧化碳,则盐为碳酸盐或碳酸氢盐;D.二氧化碳、氨气溶于水生成碳酸铵,碳酸铵和氢氧化钙反应生成难溶性的碳酸钙。
A.二氧化氮为红棕色气体,温度高,颜色深,则2NO2N2O4为放热反应,即△H<0,选项A正确;B.量的溴水分别滴入FeCl2溶液、NaI溶液中,分别反应生成铁离子、碘单质,不能比较亚铁离子、碘离子的还原性,选项B错误;C.白色沉淀为碳酸钙,气体为二氧化碳,则盐为碳酸盐或碳酸氢盐,则该钾盐是K2CO3或KHCO3,或二者都有,选项C错误;D.碳酸氢铵分解生成二氧化碳、氨气和水,氨气和二氧化碳溶于氢氧化钙溶液生成碳酸铵,碳酸铵和氢氧化钙反应生成难溶性的碳酸钙,所以不符合实验现象,选项D错误。答案选A。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】核磁共振氢谱是研究有机物结构的有力手段之一,例如乙醛的结构简式为CH3-CHO,在核磁共振氢谱中有两个峰,其峰面积之比为3:1。
(1)结构式为![]() 的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
的有机物,在核磁共振氢谱上吸收峰的面积之比为 __________;
(2)某含氧有机物,其质谱图中最大质荷比为46.0,碳的质量分数为52.2%,氢的质量分数为13.0%,核磁共振氢谱中只有一个吸收峰,则该有机物的相对分子质量为___________,其结构简式是 _________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )

A. 原子半径:b>c>a>d B. 气态氢化物热稳定性:a>d
C. d的氧化物常用于太阳能电池 D. 工业上电解c的氯化物冶炼单质c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用硫铁矿(FeS2)焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
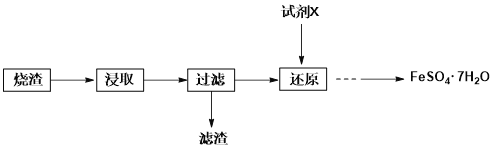
(1)试剂X可能为______________。
A.双氧水 B.酸性高锰酸钾 C.浓硫酸 D.SO2
(2)从还原后溶液中得到产品,应进行的操作是___________、____________、过滤、洗涤、干燥。
(3)七水合硫酸亚铁(FeSO4·7H2O)在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成500 mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,逐渐滴加0.0500 mol/L的酸性KMnO4溶液,至恰好完全反应,记录消耗的酸性KMnO4溶液的体积(假定药品中其他成分不与酸性KMnO4反应);
步骤c:重复步骤b2~3次,平均消耗酸性KMnO4溶液20.00mL。
已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则该补血剂中亚铁离子的含量为_____mg/片。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型电池的开发与使用在现代社会中已很普遍,一种水煤气燃料电池的能量转化率可达90%以上。下列说法正确的是
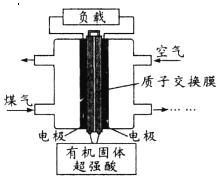
A. 总反应为2CO+O2==2CO2
B. 负极反应为H2-2e—==2H+、CO-2e—+H2O==CO2+2H+
C. 电路中通过4 mol电子,正极消耗22.4 L(标准状况)空气
D. 有机固体中的H+在放电时向正极移动,造成正极pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于SO2的叙述中,正确的是( )
A. SO2的摩尔质量是64g
B. 1 molSO2中所含分子数约为6.02×1023个
C. 1 molSO2的质量是64g/mol
D. 常温常压下,1 molSO2的体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1911年,科学家发现汞在4.2K以下时电阻突然趋近于零——即低温超导性。1986年,科学家又发现了Nb3Ge在23K下具有超导性。1987年2月,赵忠贤及合作者独立发现了在液氮温区(沸点77 K)的高温超导体,其晶胞如图所示,元素组成为Ba-Y-Cu-O(临界温度93 K),推动了国际高温超导研究。赵忠贤院士获得2016年度国家最高科学技术奖。
回答下列问题:
(1)铌Nb位于第五周期,Nb的外围电子排布式为4d45s1,Nb位于_______族
(2)下列关于Ge元素叙述正确的是______(从下列选项中选择)
A.Ge晶体属于准金属,且为共价晶体 B.Ge属于p区的过渡金属
C.Ge的第一电离能比As、Se均要小 D.Ge的电负性比C大
(3)Ge(CH3)2Cl2分子的中心原子Ge的杂化方式是______________
(4)NH3也常作致冷剂,其键角_______(填“大于”或“小于”)109°28′,NH3的沸点(239.6 K)高于N2沸点的主要原因是___________________________
(5)图示材料的理想化学式(无空位时)为___________________,若Y(钇)元素的化合价为+3,则Cu的平均化合价为_______
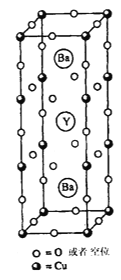
(6)金属铜属于面心立方最密堆积,其晶胞中Cu原子的最近距离为a cm,金属铜的晶体密度为ρ g/cm3,阿伏伽德罗常数为NA,则铜的相对原子质量为________ (只含一个系数,用a、ρ、NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |

图中表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是( )
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。

回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:___________、__________。
(3)得到FeSO47H2O晶体的操作Ⅲ为:加热浓缩、冷却结晶、______、______、干燥。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com