
【题目】短周期元素a、b、c、d的原子序数依次增大,a和b的价电子数之和等于c和d的最外层电子数之和,这四种元素组成两种盐b2da3和bca2。在含该两种盐的混合溶液中滴加盐酸,产生白色沉淀的物质的量与盐酸体积的关系如图所示。下列说法正确的是( )

A. 原子半径:b>c>a>d B. 气态氢化物热稳定性:a>d
C. d的氧化物常用于太阳能电池 D. 工业上电解c的氯化物冶炼单质c
科目:高中化学 来源: 题型:
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:

请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化的情况如图甲所示。图乙为t2时刻后改变反应条件,该平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3~t4阶段为使用催化剂;图甲中t0~t1阶段c(B)未画出。
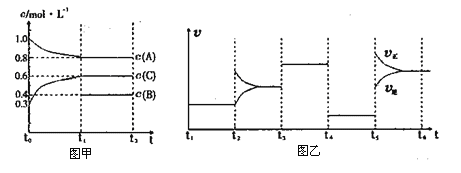
下列说法不正确的是
A. 该反应为吸热反应
B. B在t0~t1阶段的转化率为60%
C. t4~t5阶段改变的条件为减小压强
D. 此温度下该反应的化学平衡常数K=0.84
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是( )
A. 纤维素、蔗糖水解的最终产物相同
B. 丙烯与溴的四氯化碳溶液反应生成1,3-二溴丙烷
C. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
D. ![]() 的苯环上一氯代物有3种
的苯环上一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、KClO3和浓盐酸在一定温度下反应,还原产物为黄绿色的易爆物二氧化氯。其变化可以表示为:□KClO3+□HCl(浓)→□KCl+□ClO2↑+□Cl2↑+□H2O+□__________
(1)请配平该化学方程式_____________________________________。
(2)浓盐酸在反应中显示出来的性质是______________________________(填编号)。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
Ⅱ、已知反应:2H2CrO4+3H2O2=2Cr(OH)3↑+2H2O该反应中H2O2只发生如下变化过程H2O2→H2O
(1)该反应中的还原剂是__________________________。
(2)该反应中被还原的元素是_______________,还原产物是_____________________。
(3)若产生的气体在标准状况下体积为3.36L,则反应中转移了_________mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素。从海带中提取碘的工业生产过程如下,下列说法错误的是

A. 过程①的分离方法是过滤,需要用到的玻璃仪器有漏斗、玻璃棒及烧杯
B. 加入NaOH溶液的目的是使可溶性有机质形成沉淀
C. 在氧化过程中可以选用氯水作为氧化剂
D. 过程②在工业上常采用萃取分液的方法得到碘单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探究不溶性固体X的组成和性质,进行了如下实验。已知X是一种仅含有四种元素的具有固定成的盐类物质,H由碘元素和另外一种元素组成,图中所有气体体积均在标准状况下测定。
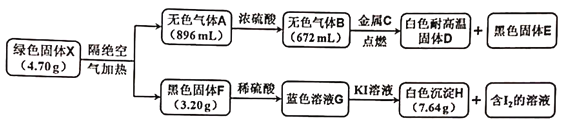
请回答下列问题:
(1)写出X的化学式__________;
(2)写出C的原子结构示意图___________;组成E元素的某种核素常用于考古断代,该原子核内中子数为8,写出该校素的原子符号___________。
(3)C在装有B的集气瓶中燃烧,其实验现象为___________;并写出相应的化学方程式___________。
(4)已知H能与含NaClO的碱性溶液反应生成NaIO3和蓝色絮状沉淀,试写出该反应的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象和解释或结论都正确的是
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 将充满NO2 的密闭玻璃球浸泡在热水中 | 红棕色变深 | 反应2NO2 N2O4 的 |
B | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡 | 下层分别呈无色和紫红色 | 还原性:I->Br->Fe2+ |
C | 某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水 | 有白色沉淀出现 | 该钾盐是碳酸钾 |
D | 将碳酸氢铵受热分解产生的气体通入某溶液 | 溶液变浑浊,继续通入该气体,浑浊消失 | 该溶液是氢氧化钙溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | 酸的强弱:HX<HY |
B | 向2 mL 0.1 mol/L Na2S溶液中滴2滴0.1 mol/L ZnSO4溶液;再滴2滴0.1 mol/L CuSO4 | 先生成白色沉淀,后生成黑色沉淀 | 溶度积(Ksp):ZnS>CuS |
C | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+3KSCN |
D | 常温下,用pH计分别测定饱和NaA溶液和饱和NaB溶液的pH | pH:NaA>NaB | 常温下酸性:HA﹤HB |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com