
A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体。
(1)M的基态原子价层电子排布式为_____,元素B、D、G的第一电离能由大到时小的顺序是_____ (用元素符号表示)。
(2)用价层电子对互斥理论预测,GD32-的立体构型是_____ (用文字表述)
(3)M与D形成的一种橙红色晶体晶胞结构如图所示,其化学式为_____ (用元素符号表示)。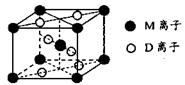
(4)已知化合物EB结构与单晶硅相似,该物质可由E 的氯化物与NaB3在高温下反应制得,且生成单质B2,该反应化学方程式为_____,若有8.4gB2生成,则转移电子数为_____。
(14分)
(1)3d24s2(2分) N>O>S(2分)
(2)三角锥形(2分)
(3)TiO2(3分)
(4)AlCl3+3NaN3= 3NaCl+AlN+4N2↑(3分) 1.204×1023或0.2NA(2分)
解析试题分析:A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大。其中元素M的基态3d轨道上有2个电子,价层电子排布式3d24s2,为钪元素;A的基态原子L层电子数是K层电子数的2倍,元素A为碳元素,E的简单离子在同周期元素的简单离子中半径最小,元素E为铝;B与D形成的化合物有多种,其中一种是红棕色气体,很显然元素B为氮元素,D为氧元素。D、G同主族,G为硫元素;
考点:考查元素的核外电子排布式、元素的杂化类型,元素原子半径比较。


科目:高中化学 来源: 题型:单选题
下列关于晶体的说法一定正确的是( )
| A.分子晶体中都存在共价键 |
| B.CaTiO3晶体中每个Ti4+和12个O2-相紧邻 |
| C.SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
| D.金属晶体的熔点都比分子晶体的熔点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
形成物质世界多样性的原因有:( )
①元素种类 ②同位素 ③化学键成键方式 ④同分异构现象 ⑤同素异形现象
| A.仅①②③ | B.仅②④⑤ |
| C.仅①③ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰-Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围____________个水分子以氢键结合,晶体中,1 mol水可形成________ mol氢键。
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知尿素的结构式为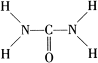 : 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
: 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)基态Fe3+的核外电子排布式为 ;C、N、O三种元素的第一电离能由大到小的顺序是 。
(2)尿素分子中N原子的杂化方式是 。
(3)NH+4中H—N—H键角比NH3中H—N—H键角大,原因为 。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。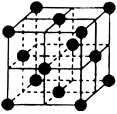
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②NaCl晶胞也为面心立方结构,已知NaCl晶体密度为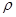 g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3,NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ下列描述中正确的是( )
| A.CS2为V形的极性分子 |
B.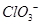 的空间构型为平面三角形 的空间构型为平面三角形 |
| C.SF6中有6对完全相同的成键电子对 |
D.SiF4和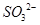 的中心原子均为sp3杂化 的中心原子均为sp3杂化 |
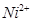 和
和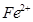 的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
的离子半径分别为69pm和78pm,则熔点NiO_________________FeO(填“<”或“>”);
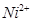 :在稀氨水介质中,丁二酮肟与
:在稀氨水介质中,丁二酮肟与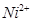 反应可生成鲜红色沉淀,其结构如右上图所示。
反应可生成鲜红色沉淀,其结构如右上图所示。查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法或表示方法正确的是( )
| A.等物质的量的硫蒸气和硫粉分别完全燃烧,后者放出热量多 |
| B.由C(石墨)→C(金刚石) ΔH=+11.9kJ·mol-1可知,金刚石比石墨稳定 |
| C.在25℃,101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1 |
| D.H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3kJ·mol-1,若将含0.5molH2SO4的浓硫酸与含1molNaOH的氢氧化钠溶液混合,放出的热量等于57.3kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在298K、100kPa时,已知: ①2H2O(g)=O2(g)+2H2(g) ΔH1
② Cl2(g)+H2(g)=2HCl(g) ΔH2 ③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.Δ H3=ΔH1+2ΔH2 | B.Δ H3=ΔH1+ΔH2 |
| C.Δ H3=ΔH1-2ΔH2 | D.Δ H3=ΔH1-ΔH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于化学反应与能量的说法正确的是
| A.中和反应是吸热反应 |
| B.燃烧是放热反应 |
| C.化学键断裂放出能量 |
| D.反应物总能量与生成物总能量一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com