
【题目】已知高锰酸钾在常温下能与盐酸溶液反应,其反应的化学方程式如下:2KMnO4+16HC1=2KCl+2MnCl2+5Cl2↑+8H2O
(1)用双线桥表示电子转移的方向和数目__________________________。
(2)上述反应中氧化剂是__________,氧化产物是__________。
(3)上述反应中氧化剂与还原剂的物质的量之比为__________。
(4)若反应中转移了0.6mol 电子,产生的气体在标准状况下的体积是__________。
【答案】 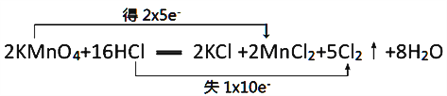 KMnO4 Cl2 1∶5 6.72L
KMnO4 Cl2 1∶5 6.72L
【解析】试题分析:本题考查双线桥分析氧化还原反应,氧化还原反应的有关概念和计算。
(1)用双线桥分析该反应: ,答案为:
,答案为: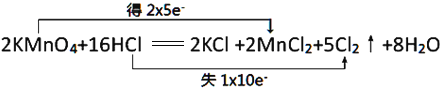 。
。
(2)Mn元素的化合价由KMnO4中+7价降至MnCl2中+2价,氧化剂为KMnO4。Cl元素的化合价由HCl中的-1价升至Cl2中的0价,Cl2为氧化产物。
(3)反应中参与反应的KMnO4为2mol,2molKMnO4都被还原;参与反应的HCl为16mol,其中10molHCl被氧化;氧化剂与还原剂物质的量之比为2:10=1:5。
(4)根据(1)中的分析,每转移10mol电子生成5molCl2,转移0.6mol电子生成0.3molCl2,生成的Cl2在标准状况下的体积为0.3mol![]() 22.4L/mol=6.72L。
22.4L/mol=6.72L。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是
A. 硅元素在自然界里均以化合态存在
B. SiO2不能与水反应生成硅酸,不是酸性氧化物
C. 除去二氧化硅中少量的碳酸钙杂质应选用水
D. 粗硅制备时,发生的反应为C+SiO2=Si+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于碳骨架异构的是( )
A.CH3CH2CH2CH3和CH3CH(CH3)2
B.CH2=CHCH2CH3和CH3CH=CHCH3
C.顺-1,2-二氯乙烯和反-1,2-二氯乙烯
D.CH3CH2CH2COOH 和CH3COOCH2CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝表面在空气中天然形成的氧化膜耐磨性和抗蚀性不够强。控制一定的条件,用如图所示的电化学氧化法,可在铝表面生成坚硬致密,耐腐蚀的氧化膜。下列有关叙述正确的是

A. 阴极上有金属铝生成
B. 电极A为石墨,电极B为金属铝
C. OH-在电极A上放电,有氧气生成
D. 阳极的电极反应式为:2Al-6e-+3H2O═AL2O3+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 氧化还原反应中一定有电子的得失
B. 元素由化合态变成游离态时,它可能被氧化,也可能被还原
C. 失电子难的原子,获得电子的能力一定强
D. 有单质参加或生成的反应一定属于氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图为实验室蒸馏自来水得到少量蒸馏水的装置示意图,请根据图示回答下列问题:

(1)装置中仪器A的名称是___________,仪器B 的名称是_____________。
(2)请指出上图中的三处明显错误中的两处:__________、__________。
Ⅱ.选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.蒸馏 B.过滤 C.结晶 D.分液
(1)分离水和煤油的混合物__________。
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾__________。
(3)从加热氯酸钾制氧气后的剩余固体中获得MnO2。溶解、__________。
(4)分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷和乙炔的混合气体20 mL,完全燃烧需45 mL氧气(同温同压下),则此混合气体中甲烷和乙炔的体积比是( )
A.1∶1B.2∶1C.3∶1D.4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用硝酸氧化淀粉水解的产物(C6H12O6)可以制备草酸,装置如下图所示(加热、搅拌和仪器固定装置均己略去)。

实验过程如下:
①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,得到淀粉水解液,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后得草酸晶体粗品,再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入少许98%硫酸的目的是:_____________________。
(2)冷凝水的进口是________(填a或b);实验中若混酸滴加过快,将导致草酸产量下降,其原因是______________________。
(3)装置B的作用是___________,为使尾气被充分吸收,C中的试剂是___________。
(4)重结晶时,将草酸晶体粗品经I加热溶解、Ⅱ趁热过滤、Ⅲ冷却结晶、Ⅳ过滤洗涤、Ⅴ干燥等实验步骤,得到较纯净的草酸晶体。该过程中可将粗品中溶解度较大的杂质在_________(填上述实验步骤序号)时除去;而粗品中溶解度较小的杂质最后留在_______(填“滤纸上”或“滤液中”)。
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。称取一定量该样品加适量水完全溶解,用KMnO4标准液滴定,反应的离子方程式为_________________。 滴定前后滴定管中的液面读数如图所示,则消耗KMnO4溶液的体积为_________。

(6)已知草酸是一种二元弱酸,草酸氢钠溶液(NaHC2O4)显酸性。常温下,向10 mL0.01 mol L -1IH2C2O4溶液中加入10mL0.01mol·L-1NaOH溶液时,溶液中各种离子的浓度由大到小的顺序为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com