
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
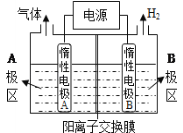
①B极区电解液为__________溶液(填化学式),A极要连接电源的________(填“正”或“负”)极。
②阳极电极反应式为______________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是_____________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)
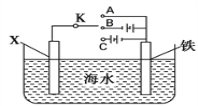
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
(3)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O![]() V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
【答案】NaOH 正2Cl—2e=Cl2↑B2Cl-+2H2O ![]() Cl2↑+H2↑+2OH-C牺牲阳极的阴极保护法VO2++2H++e-═VO2++H2OV3++e-═V2+升高
Cl2↑+H2↑+2OH-C牺牲阳极的阴极保护法VO2++2H++e-═VO2++H2OV3++e-═V2+升高
【解析】
(1)电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液,由图可知,右侧生成氢气,则B中氢离子放电,可知B为阴极,在B中制备NaOH,B极区电解液为NaOH溶液;Na+由A经过阳离子交换膜向B移动;A中为NaCl溶液,氯离子放电生成氯气,则阳极反应式为2Cl--2e-=Cl2↑;
①根据图示可知,B极有氢气产生,为电解池的阴极,B极区电解液为NaOH溶液,A极为电解池的阳极要连接电源的正极;正确答案:NaOH;正。
②阳极电极反应式为2Cl--2e-=Cl2↑,电解过程中Na+向B电极迁移;正确答案:2Cl--2e-=Cl2↑;B。
③电解饱和食盐水生成氯化钠、氯气和氢气,总反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-;正确答案:2Cl-+2H2O
Cl2↑+H2↑+2OH-;正确答案:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)①若X为碳棒,开关K应置于A处,构成原电池,Fe为负极,加速Fe的腐蚀;开关K应置于B处,构成电解池,Fe为阳极,加速铁的腐蚀;开关K应置于C处,构成电解池,Fe为阴极,被保护,减缓铁的腐蚀;正确答案:C。
②若X为锌,开关K应置于A处,构成原电池,Zn为负极,Fe被保护,减缓铁的腐蚀,该方法为牺牲阳极的阴极保护法;正确答案:牺牲阳极的阴极保护法。
(3)正极反应是还原反应,由电池总反应可知放电时的正极反应为VO2++2H++e-![]() VO2++H2O;电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,极反应为:V3++e-═V2+;放电为原电池,总反应为V2++VO2++2H+=VO2++V3++H2O,氢离子浓度减小,酸性减小,电解液的pH升高;正确答案:VO2++2H++e-═VO2++H2O;V3++e-═V2+;升高。
VO2++H2O;电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应,极反应为:V3++e-═V2+;放电为原电池,总反应为V2++VO2++2H+=VO2++V3++H2O,氢离子浓度减小,酸性减小,电解液的pH升高;正确答案:VO2++2H++e-═VO2++H2O;V3++e-═V2+;升高。


科目:高中化学 来源: 题型:
【题目】(题文)[化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:![]()
回答下列问题:
(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为________________。
(3)由A生成B、G生成H的反应类型分别是________________、________________。
(4)D的结构简式为________________。
(5)Y中含氧官能团的名称为________________。
(6)E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为________________。
(7)X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
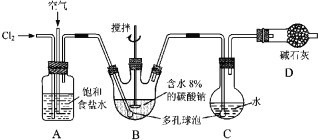
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是________________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是____________________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用_____取20.00 mL次氯酸溶液,加入足量的_________________,再加入足量的_______________,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.欲实现铁片镀锌,用锌作阴极
B.电解精炼铜,若转移2mol电子,阴极质量增加64g
C.硫酸工业中采用沸腾炉以增加固、气接触面积,加快反应速率
D.工业上常用电解熔融氯化钠法制备金属钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列判断正确的是
A. 标准状况下,2.8 g 14C18O中质子数为1.4NA
B. 常温下,0.3 mol NO2通入水中完全反应,转移的电子数为0.2NA
C. CO燃烧热为283.0 kJ/mol,若一定量的CO完全燃烧放出热量为283.0 kJ,则消耗O2分子数为NA
D. 62.0 g乙二醇中含有的羟基数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性,下列说法正确的是
A. X、Y、Z、W的原子半径依次减小
B. W与X形成的化合物中只含离子键
C. W的气态氢化物的沸点一定高于Z的气态氢化物的沸点
D. 若W与Y的原子序数相差5,则二者形成化合物的化学式一定为Y2W3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分, 表中列出10种元素在周期表中的位置,按要求回答下列各题。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑧ | ⑩ | ||||||
3 | ① | ③ | ⑤ | ⑥ | ⑦ | ⑨ | ||
4 | ② | ④ |
(1)写出下列序号所代表的元素符号③_____;⑩______
(2)写出⑥的一种用途_________________;常温下可与表中_______单质反应(填化学式
(3)元素④的原子结构示意图为________________________;
(4)⑤和⑨形成的化合物的化学式为:_____________;向该化合物的水溶液里逐滴滴入苛性钠溶液,现象为__________________________________________________.
(5)②⑤⑦⑧的原子半径由大到小的顺序是__________________________(用元素符号表示)
(6)将①⑤同时投入到水中,发生反应的化学方程式有:______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)![]() xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
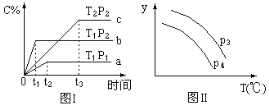
A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列叙述中正确的是
A. 常温常压下,17g 甲基(-14CH3)所含的中子数为 9 NA
B. 电解精炼铜的过程中,若阳极减轻 64 g,则电路中一定通过 2NA 个电子
C. NA 个 Fe(OH)3 胶体粒子的质量为 107 g
D. 1mol 铜与足量硫蒸气反应,转移电子数为 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com