
【题目】如图所示(B中冷却装置未画出),将氯气和空气(不参与反应)以体积比约1∶3混合通入含水8%的碳酸钠中制备Cl2O,并用水吸收Cl2O制备次氯酸溶液。
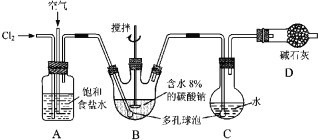
已知:Cl2O极易溶于水并与水反应生成HClO;Cl2O的沸点为3.8 ℃,42 ℃以上分解为Cl2和O2。
(1)①实验中控制氯气与空气体积比的方法是________________________________。
②为使反应充分进行,实验中采取的措施有______________________________。
③装置D的作用是____________________________________。
(2)①装置B中产生Cl2O的化学方程式为:____________________________________。
②若B无冷却装置,则进入C中的Cl2O会大量减少。其原因是_____________________。
(3)装置C中采用棕色圆底烧瓶是因为______________________________________。
(4)已知次氯酸可被H2O2、FeCl2等物质还原成Cl-。测定C中次氯酸溶液的物质的量浓度的实验方案为:用_____取20.00 mL次氯酸溶液,加入足量的_________________,再加入足量的_______________,过滤,洗涤沉淀,在真空干燥箱中干燥,用电子天平称量沉淀质量。 (可选用的试剂:H2O2溶液、FeCl2溶液、AgNO3溶液)。
【答案】通过观察A中产生气泡的速率调节流速 搅拌、使用多孔球泡 吸收未反应的氯气,防止污染空气 2Cl2+Na2CO3===Cl2O+2NaCl+CO2 该反应放热,温度升高Cl2O会分解 HClO见光易分解 酸式滴定管 H2O2溶液 硝酸银溶液
【解析】
氯气通过A装置与空气形成1:3的混合气体通入B装置,在搅拌棒的作用下与含水8%的碳酸钠充分反应制备Cl2O,并用水吸收Cl2O制备次氯酸钠溶液,同时用碱石灰吸收含有Cl2O的尾气,防止污染环境,(1)①控制氯气与空气体积比的方法可以通过观察A中产生气泡的比例来调节气体的流速;②增加气体与溶液的接触面积、搅拌等措施都可以加快反应速率;③装置D的作用是是吸收未反应的氯气,防止污染空气;(2)①装置B中,氯气本身既作为氧化剂又作还原剂,本身被氧化到+1价的Cl2O,被还原到-1价的氯化钠;②由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少;(3)装置C是用水吸收Cl2O制备次氯酸溶液,但生成的HClO见光易分解,反应装置须选择避光;(4)需要20.00mL的次氯酸溶液,根据精确度应选用酸、碱式滴管,再根据HClO溶液既有酸性,又有强氧化性确定滴定管的类型;实验原理是结合所提供的试剂H2O2是还原HClO生成Cl-,再滴加过量提供的硝酸银溶液,根据生成的AgCl沉淀质量计算原溶液HClO的浓度。
(1)①通过观察A中产生气泡的速率调节气体的流速可以控制氯气与空气体积比的方法;②多孔球泡增加气体与溶液的接触面积可以加快反应速率;为使反应充分进行,实验中采取的措施有搅拌、使用多孔球泡;③装置D的作用是吸收未反应的氯气,防止污染空气;
(2)①装置B中,氯氯气和碳酸钠反应生成Cl2O,化学方程式为:2Cl2+Na2CO3=Cl2O+2NaCl+CO2;②由于该反应为放热反应,温度升高Cl2O会分解,故进入C中的Cl2O会大量减少;
(3)水吸收Cl2O制备次氯酸溶液,HClO见光易分解,故装置C中采用棕色圆底烧瓶;
(4)次氯酸溶液既有酸性,又有强氧化性,应选用酸式滴定管;具体实验操作是,向20.00mL的次氯酸溶液里加入足量的H2O2溶液,再加入足量的AgNO3溶液,过滤、洗涤,在真空干燥箱中干燥沉淀,用电子天平称量沉淀的质量。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图是锂—空气电池的放电原理图(隔膜只允许锂离子通过)。电池放电时的反应可表示为:4Li+O2+2H2O=4LiOH。下列锂—空气电池放电时的有关说法正确的是( )
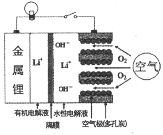
A. 正极反应式:Li-e-=Li+
B. 每转移2mol电子,消耗11.2L的O2
C. Li+不断向电池的正极移动
D. 可以去掉隔膜和有机电解液,让金属锂与水性电解液直接接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质对应的化学式错误的是
A.偏铝酸钡 Ba(AlO2)2B.明矾 KAl(SO4)2·12H2O
C.醋酸钙 (CH3COO)2CaD.亚硫酸氢钙 CaHSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 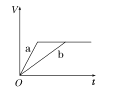 B.
B. 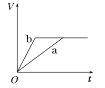 C.
C. 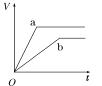 D.
D. 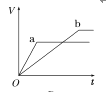
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C—C键可以绕键轴自由旋转,结构简式为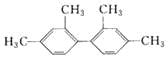 的烃,下列说法中正确的是
的烃,下列说法中正确的是
A. 分子中至少有9个碳原子处于同一平面上
B. 分子中至少有11个碳原子处于同一平面上
C. 分子中至少有16个碳原子处于同一平面上
D. 该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为V L的密闭容器中进行反应:aN(g) ![]() bM(g),M、N的物质的量随时间的变化曲线如图所示:
bM(g),M、N的物质的量随时间的变化曲线如图所示:
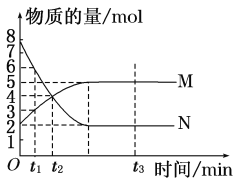
(1)此反应的化学方程式中a∶b=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为________。
(3)下列叙述中能说明上述反应达到平衡状态的是________________________________________________________________________。
A.反应中M与N的物质的量之比为1∶1
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的转化率达到最大,且保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应:H2(g) + I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1
2HI(g) ΔH=-a kJ·mol-1
已知: (a、b、c均大于零)
(a、b、c均大于零)
下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。
(1)利用下图装置电解制备NaOH,两电极区电解液分别为NaOH和NaCl溶液。
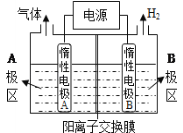
①B极区电解液为__________溶液(填化学式),A极要连接电源的________(填“正”或“负”)极。
②阳极电极反应式为______________________________________,电解过程中Na+向____________电极迁移(填“A”或“B”)。
③电解总反应的离子方程式是_____________________________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
①若X为碳电极,为减缓铁的腐蚀,开关K应置于________处。(填“A”、“B”或“C”)
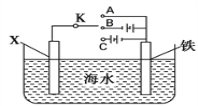
②若X为锌电极,开关K置于A处,该电化学防护法称为______________________。
(3)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O![]() V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
V2++VO2++2H+。放电时的正极反应式为___________________________充电时的阴极反应式为______________________________。放电过程中,电解液的pH________(选填“升高”“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于强弱电解质及非电解质的组合完全正确的是( )
选项 | ① | ② | ③ | ④ |
强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
弱电解质 | HF | BaSO4 | HClO | CH3COOH |
非电解质 | Cl2 | CS2 | 蔗糖 | H2CO3 |
A.①B.②C.③D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com