
| A. | 混合浓硫酸和乙醇时,应将乙醇慢慢注入到浓硫酸中 | |
| B. | 萃取、配制物质的量浓度的溶液都要用到玻璃棒 | |
| C. | 用丁达尔效应可鉴别溶液和胶体 | |
| D. | 可用氢氧化钠溶液除去乙酸乙酯中混有的乙酸 |
分析 A.与酸混合时,将密度大的液体注入密度小的液体中;
B.萃取需要分液漏斗,配制溶液需要玻璃棒搅拌、引流;
C.丁达尔现象为胶体特有的性质;
D.乙酸乙酯、乙酸均与NaOH反应.
解答 解:A.混合浓硫酸和乙醇时,应将浓硫酸慢慢注入到乙醇中,并不断搅拌,使产生的热量及时散失,故A错误;
B.萃取需要分液漏斗,配制溶液需要玻璃棒搅拌、引流,则萃取不需要玻璃棒,故B错误;
C.丁达尔现象为胶体特有的性质,则可用丁达尔效应可鉴别溶液和胶体,故C正确;
D.乙酸乙酯、乙酸均与NaOH反应,不能除杂,应选饱和碳酸钠溶液、分液除去乙酸乙酯中混有的乙酸,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握实验基本操作、混合物分离提纯、物质的鉴别等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:实验题
 ,丙的电子式为
,丙的电子式为 ,E在周期表中的位置为第三周期VA族.
,E在周期表中的位置为第三周期VA族.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 已知 N2(g)+3H2 (g)═2NH3(g)△H=-92.4 kJ•mol-1,当有 1molNH3时,上述反应的△H 变为-46.2 kJ•mol-1 | |
| B. | 1mol 羟基(-OH)与 17gNH3所含电子数都为NA | |
| C. | 由 8.0gCH3COONa 和少量 CH3COOH 形成的中性溶液中,CH3COO-数目为0.1NA | |
| D. | 常温常压下,7.1gCl2与足量的Fe粉反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入过量CO2:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- | |
| B. | NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | Cu溶于稀硝酸HNO3:Cu+2H++NO3-═Cu2++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | ①②③ | C. | 只有②③ | D. | 只有①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:填空题
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学等多个领域潜在应用的有力工具。水热法制备Fe3O4纳米颗粒的反应是
3Fe2+2S2O +O2+xOH-
+O2+xOH- Fe3O4↓+S4O
Fe3O4↓+S4O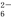 +2H2O。
+2H2O。
请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________________,S2O 中S的化合价为________________.
中S的化合价为________________.
(2)反应的化学方程式中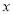 =____________.
=____________.
(3)每生成 1mol Fe3O4,反应转移的电子为_________mol,被Fe2+还原的O2的物质的量为________mol.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
化学是以实验为基础的学科,化学实验设计和操作中必须十分重视安全问题和环境保护问题。下列操作不是围绕上述问题的是
A. 用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停止加热
B. 在氢气还原氧化铜停止加热后,还要继续通一会儿氢气
C. 实验室制备CO气体必须在通风橱中进行
D. 蒸馏操作时应在混合液中加入沸石
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com