
【题目】下列实验现象或图象信息不能充分说明相应的化学反应是放热反应的是( )
A. | B. | C. | D. | |
反应 |
|
|
|
|
实验现象 | 温度计的水银柱不断上升 | 反应物总能量大于生成物总能量 | 反应开始后,甲处液面低于乙处液面 | 反应开始后,针筒活塞向右移动 |
A.A
B.B
C.C
D.D
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 中子数为20的氯原子: ![]() Cl B. 硫离子的结构示意图:
Cl B. 硫离子的结构示意图:
C. N2H4的电子式:![]() D. 丙烯的结构简式:CH2CHCH3
D. 丙烯的结构简式:CH2CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以软锰矿(主要成分为MnO2,还有少量FeO、Fe2O3、MgO和Al2O3杂质)为原料制备高锰酸钾的流程如下图:

(1) “酸浸”需要加热的目的是__________,此过程中发生反应的离子方程式是______________。(任写一条)
(2) “熔融”过程中,MnO2被KC1O3氧化成K2MnO4。
①该反应的化学方程式为_____________________。
②加入KC1O3应过量的原因除了提高MnO2利用率,还有_________________.
③将适量KClO3和KOH混合均匀后在坩埚内高温反应,应选用坩埚为__________。(选填序号)
a.石英坩埚 b.铁坩埚 c.氧化铝坩埚
(3)己知:①MnO42-只存在于强碱环境(pH>13.5)中,当pH降低时,MnO42-会歧化为MnO4-和MnO2;②饱和碳酸钾溶液的pH约为12.3,饱和碳酸氢钾溶液的pH约为8.8;③相关物质的溶解度曲线如下图。

请补充完整由浸取液制备KMnO4晶体的实验方案:向浸取液中缓缓通入CO2,_____________,低温供干得KMnO4晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 .
(2)表中能形成两性氢氧化物的元素是(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式 .
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铈(58Ce)常用于制作稀土磁性材料,可应用于制造玻璃、打火石、陶瓷和合金等.已知:Ce4++Fe2+═Ce3++Fe3+ . 下列说法正确的是( )
A.Ce元素位于元素周期表第六周期第IIIB族
B.![]() Ce、
Ce、 ![]() Ce是同素异形体
Ce是同素异形体
C.铈能溶于HI溶液,发生反应的离子方程式为:Ce+4H+=Ce4++2H2
D.铈的原子核外有58个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:

(1) Na2MoO4·2H2O中钼元素的化合价是_________。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是_________________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 gMoO3,反应中,转移电子的数目为____________。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是_______________(填序号)。
a.Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_____________________。
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向2L体积固定的密闭容器中加入1molHI,2HIH2(g)+I2(g)△H>0,H2的物质的量随时间的变化如图示,下列说法正确的是( )
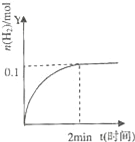
A. 该温度下,反应的平衡常数是![]()
B. 0~2min内的HI的平均反应速率为0.05molL﹣1min﹣1
C. 恒压下向该体系中加入N2,平衡不移动,反应速率不变
D. 升高温度,平衡向正反应方向移动,只有正反应速率加快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com