
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。

试回答:
(1)仪器A的名称是__________;
(2)C装置的作用是__________;
(3)D 装置的作用是__________;
(4)E中发生化学反应的方程式为:_____________________________;
(5)烧杯G 中发生反应的化学方程式为:_______________________________________。
【答案】圆底烧瓶 吸收氯化氢气体 干燥 2Fe+Cl2![]() 2FeCl3 氯气跟氢氧化钠反应
2FeCl3 氯气跟氢氧化钠反应
【解析】
在加热条件下,二氧化锰和浓盐酸反应生成氯气、氯化锰和水;浓盐酸具有挥发性,导致制取的氯气中含有HCl,HCl极易溶于水,饱和食盐水中含有氯离子抑制氯气溶解,所以用饱和食盐水吸收氯化氢;D中含有浓硫酸,浓硫酸具有吸水性,能作干燥剂;在加热条件下,铁丝和氯气发生氧化还原反应生成氯化铁;氯气密度大于空气且常温下和空气不反应,可以采用向上排空气法收集氯气;氯气有毒不能直接排空,可以用碱性物质吸收氯气。
(1)根据仪器的构造可知,仪器A的名称是圆底烧瓶;
(2)浓盐酸具有挥发性,制备的氯气中含有氯化氢,要制备纯净的氯气应除去氯化氢,C装置的作用是吸收氯化氢气体;
(3)从A中出来的氯气含有水蒸气,进入E装置前应进行干燥,所以D装置的作用是干燥氯气;
(4)E中干燥的氯气与细铁丝在加热条件下反应生成氯化铁,发生化学反应的方程式为: 2Fe+Cl2![]() 2FeCl3;
2FeCl3;
(5)氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水,烧杯G 中发生反应的化学方程式为:2NaOH+Cl2═NaCl+NaClO+H2O。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】金属是不可再生的资源,通过回收废旧的锂电池提取锂、铝、钴等重要的金属具有重大的意义。已知锂电池的正极材料为LiCoO2、炭黑、铝箔及有机粘合剂,下面是回收的工艺流程:

(1)滤液X中通入过量CO2时发生的主要反应的离子方程式为___________
(2)写出酸浸时加入H2SO4、H2O2反应的化学方程式______________________
(3)实验室中萃取分离CoSO4、Li2SO4溶液时需要加入有机物W,若实验过程中使用如图装置,则该装置中存在的主要错误有______________________
(4)已知部分物质的溶解度(g/100gH2O)情况如下表所示:
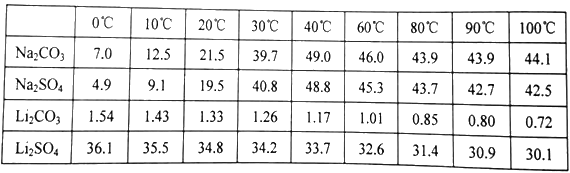
写出浓缩后的溶液中加入饱和碳酸钠溶液的离子反应方程式______________________;为提高Li2CO3的产率,最后过滤实验中需要注意的问题是______________________
(5)若废旧的锂电池拆解后先使用酸溶解,最终也可以得到Al(OH)3、CoSO4、Li2CO3。在酸浸中若Al3+浓度为0.1moL·L-1,则常温时pH>______________________才能够开始形成氢氧化铝沉淀(已知氢氧化铝Ksp=1.3×10-33、lg4.26=0.6、![]() =2.35)
=2.35)
(6)已知100g废旧的锂电池中钴酸锂(LiCoO2)的含量为9.8%,若按照上述生产流程,可以生成2.4gLi2CO3,则其产率为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“空气吹出法”从海水中提取溴的工艺流程如下:

下列说法不正确的是
A. 蒸馏塔中只发生了物理变化
B. 吸收塔利用了SO2的还原性,使Br2还原成Br-
C. 在吸收塔中溴元素得到了富集
D. 吹出塔中通入水蒸气,能减小Br2的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,利用煤化工中生产的CO、CO2和H2可制取甲醇等有机物,发生的反应有:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
相关物质的化学键键能数据如下:
化学键 | C=O(CO2) | H—H | C—O | H—O | C—H |
E/(kJ·mol-1) | 803 | 436 | 343 | 465 | 413 |
(1)该反应△H2=___________。
(2)关于反应①下列说法,正确的是___________。
A.该反应在任何温度下都能自发进行
B.升高温度,正反应速率增大,逆反应速率减小
C.使用催化剂,不能提高CO的转化率
D.增大压强,该反应的化学平衡常数不变
(3)在某温度下,将1.0moCO与2.0molH2充入2L的空钢瓶中,发生反应①,在第5min时达到化学平衡状态,此时甲醇的物质的量分数为0.1。在第10min、20min时分别改变反应条件,甲醇的浓度在不同条件下的变化状况如下图所示:

①从反应开始到5min时,生成甲醇的平均速率为___________。
②H2的平衡转化率α=___________%,化学平衡常数K=___________。
③1min时,υ正___________υ逆(填“大于”“小于”或“等于”)
④1mim时υ正___________4min时υ逆(填“大于”“小于”或“等于”)
⑤比较甲醇在7~8min、12~13min和25~27min时平均反应速率[平均反应速率分别以υ(7~8)、υ(12~13)、υ(25~27)表示的大小_________________________________。
③若将钢瓶换成同容积的绝热容器,重复上述试验,平衡时甲醇的物质的量分数___________0.1。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》中记载,小米“健脾、和胃、安眠”,这主要是某种氨基酸的作用。下列有机物水解能生成氨基酸的是( )
A.蔗糖B.蛋白质C.油脂D.纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物G是一种重要的化工产品,可由烃A(C3H6)和苯合成。合成G的流程图如下:

已知:①B和C中核磁共振氢谱分别有4种和3种峰。
②CH3Cl+NaCN→CH3CN+NaCl
③CH3CN![]() CH3COOH
CH3COOH
④![]()
请回答下列问题:
(1)A的名称是___________。
(2)①的反应类型是___________,⑥的反应类型是___________。
(3)D的结构简式是______________________。
(4)E中官能团的名称是___________。
(5)⑦的反应方程式是_________________________________。
(6)F的同分异构体有多种,符合下列条件的有___________种。
①苯环对位上有两个取代基,其中一个是NH2 ②能水解 ③核磁振谱有5个峰
写出符合上述条件的一种同分异构体的结构简式______________________。
(7)参照上述流程图,写出用乙烯、NaCN为原料制备聚酯 的合成路线___________(其它无机物任选)
的合成路线___________(其它无机物任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关说法正确的是(混合后溶液体积变化忽略不计)
A. 将pH=2的盐酸和pH=5的稀硫酸等体积混合,混合液的pH=3.5
B. 将pH=11的NaOH溶液和pH=13的Ba(OH)2溶液等体积混合,混合液的pH=12
C. 将pH=2的H2X溶液稀释至原来的1 000倍,得到混合溶液的pH=5
D. 将pH=1的盐酸和0.1 mol·L-1 的Ba(OH)2溶液等体积混合,混合液的pH=12.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)CH3OH(g)△H<0.测得CO的平衡转化率与压强的关系如图所示。有关说法正确的是

A. 混合气体密度:ρ(x)>ρ(w) B. 正反应速率:v正(w)>v正(y)
C. 反应温度:T2>T3 D. 混合气体的平均摩尔质量:M(y)<M(z)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列中心原子的杂化轨道类型和分子几何构型不正确的是
A. PCl3中P原子sp3杂化,为三角锥形
B. BCl3中B原子sp2杂化,为平面三角形
C. H2S分子中,S为sp杂化,为直线形
D. CS2中C原子sp杂化,为直线形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com