
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ/mol,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出的热量为905.9 kJ
B. 平衡时v正(O2)=4/5v逆(NO)
C. 平衡后降低压强,混合气体的平均摩尔质量增大
D. 平衡后升高温度,混合气体中NO含量降低
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应(1)是自海藻灰中提取碘的主要反应,反应(2)是自智利硝石中提取碘的主要反应:2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2 (1)
2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2 (2)
下列有关说法正确的是
A. NaI和NaIO3在一定条件下能反应生成I2
B. I2在反应(1)中是还原产物,在反应(2)中是氧化产物
C. 两个反应中生成等量的I2时转移的电子数相等
D. 氧化性:MnO2>IO![]() >I2>SO
>I2>SO![]() >Mn2+
>Mn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热有如下反应:Cu2S+2Cu2O![]() 6Cu+SO2↑。下列关于该反应的说法中,正确的是
6Cu+SO2↑。下列关于该反应的说法中,正确的是
A. 每生成22.4L SO2,反应中转移6 mol电子
B. Cu2S在反应中既是氧化剂,又是还原剂
C. Cu既是氧化产物又是还原产物
D. 每生成19.2 g Cu,反应中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中配制碘水,往往是将I2溶于KI溶液中,这样就可以得到浓度较大的碘水,主要是因为发生了反应:I2(aq)+ I![]()
![]()
上述平衡体系中,![]() 的物质的量浓度c(
的物质的量浓度c(![]() )与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):
)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态):

(1)通过分析上图,该反应的正反应为 反应(填“吸热”或“放热”)。
(2)在T1温度D状态时,v正 v逆(填“>”“<”或“=”);若在T1时某状态![]() =
=![]() , 平衡状态(填“是”“不是”或“不一定是”)。
, 平衡状态(填“是”“不是”或“不一定是”)。
(3)写出该平衡常数的表达式K = 。若升高温度,K值将 (填“增大”或“减小”或“不变”,下同);若向溶液中加入少量的溴水,K值将 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化锌、硫化锌都是重要的基础化工原料。
(1)ZnO 与 Al2O3 的化学性质相似,ZnO 在 NaOH 溶液中转化成[Zn(OH)4]2的离子方程式为_____________。
(2)火法炼锌得到的氧化锌中含有铅、铜等杂质,提纯步骤如下:
![]()
![]()
①上图中的“冷凝物”为________(填化学式)。

②某温度时,在反应Ⅰ的反应炉中,起始时 c(CO)为 0.3 molL1,反应过程中 CO2 的体积分数 φ(CO2)如图所示,则反应Ⅰ的平衡常数 K=_____。
③下列措施有利于提高反应Ⅰ中 ZnO 转化率的是________。
a.增大 ZnO 的投料量 b.适当加压 c.将锌蒸气及时分离
④反应Ⅱ中,每转移 1mol 电子,反应放热 174 kJ,则 H2=_____________。
(3)测定氧化锌样品纯度:称取 0.5000g 样品,酸溶后定容于 250 mL 容量瓶中,摇匀。量取 25.00 mL 该溶液,用 0.04000 molL1 的 EDTA(Na2H2Y)标准液滴定其中的 Zn2+(反应方程式为 Zn2++H2Y2=ZnY2+2H+,杂质不反应),平行滴定三次,平均消耗 EDTA 标准液 15.12mL。
①若滴定管未用 EDTA 标准液润洗,测定结果将___(填“偏高”、“偏低”或“不变”)。
②样品纯度为:________________(列出计算式即可)。
(4)彩电荧光屏中的蓝色荧光粉含有 ZnS。将含有 0.05mol ZnS 的荧光粉溶于 500mL盐酸中,完全溶解后,溶液中 c(S2)≤__________ molL1。(已知:Ksp(ZnS)=2.5×1023,忽略溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水(如图所示)。一段时间后,发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板黏结在烧瓶底部。这时打开瓶塞,烧瓶中散发出刺鼻的气味。

(1)下列有关该实验的结论正确的是 (填字母)。
A.自发反应一定是放热反应
B.自发反应一定是吸热反应
C.有的吸热反应也能自发进行
D.吸热反应不能自发进行
(2)发生反应的化学方程式为 。
(3)从化学反应进行方向的角度解释上述现象: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在研究化学反应中的能量变化时我们通常做如图所示的实验。
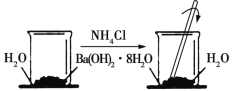
在一个小烧杯里,加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先滴有3~4滴水的玻璃片(或三合板)上,然后向烧杯内加入NH4Cl晶体约10 g,并立即用玻璃棒迅速搅拌。
试回答下列问题:
(1)实验中要立即用玻璃棒迅速搅拌的原因是 。
(2)如果实验中没有看到“结冰”现象,可能的原因是 (要求答出三个以上的原因)。
(3)如果实验中没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?
(要求答出两种方案)。
(4)该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为 ( )
A. 0.1(b-2a)mol·L-1 B. 10(2a-b) mol·L-1
C. 10(b-2a) mol·L-1 D. 10(b-a) mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com