
【题目】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
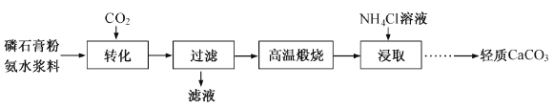
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
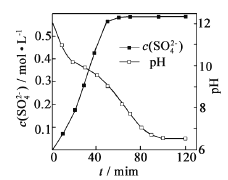
A.搅拌浆料 | B.加热浆料至100℃ |
C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
【答案】CaSO4+2NH3·H2O+CO2=CaCO3+2NH4+或CaSO4+CO32-=CaCO3+SO42- AC SO42- HCO3- 取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全 浸取液温度上升,溶液中c(H+)增大,促进固体中Ca2+浸出。
【解析】
(1)向磷石膏粉、氨水浆料中通入CO2,CO2与NH3·H2O 发生反应:CO2+2NH3·H2O===2NH4++CO32-+H2O,CO32-浓度增大,促进了CaSO4沉淀的转化:CaSO4+CO32-===CaCO3+SO42-,总反应的离子方程式为CaSO4+2NH3·H2O+CO2===CaCO3+2 NH4++SO42-+H2O。A.搅拌浆料,可增大反应物的接触面积,加快化学反应速率,A正确;B.加热浆料,由于NH3的挥发,导致NH3·H2O浓度降低,不利于CO32-的生成,降低了CaSO4的转化速率,B错误;C.增大氨水浓度,有利于提高CO32-的浓度,从而提高CaSO4的转化速率,C正确;D. 减小CO2通入速率,不利于CO32-的生成,从而降低CaSO4的转化速率,D错误,答案选AC。
(2)由图象可知,pH=6.5时,溶液中的c(Ca2+)已经很小,此时通入的CO2与溶液中浓度较低的氨水反应生成NH4HCO3,故溶液中物质的量浓度最大的两种阴离子为SO42-和HCO3-。过滤得到的CaCO3沉淀上会附着SO42-、NH4+、HCO3-等杂质离子。检验洗涤是否完全时,可取少量最后一次从过滤器中流出的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,检验是否存在SO42-即可。若不产生白色沉淀,表明沉淀已洗涤完全。
(3)NH4Cl溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,温度升高,上述水解平衡右移,c(H+)增大,导致部分CaCO3溶解,促进固体中Ca2+浸出,浓度增大。
NH3·H2O+H+,温度升高,上述水解平衡右移,c(H+)增大,导致部分CaCO3溶解,促进固体中Ca2+浸出,浓度增大。


科目:高中化学 来源: 题型:
【题目】(1)Na2O2__________(填“是”或“否”)属于碱性氧化物,Na2O2是______色固体粉末。向包有Na2O2固体的棉花上滴几滴水,棉花很快燃烧起来,原因是该反应有氧气生成且该反应为__________(填”吸热”或者“放热”)反应;
(2)Na2O2作为在潜水艇和消防员呼吸面具中的供氧剂,写出其中一个反应的化学方程式_________,某潜水艇中有50人,若每人每小时消耗O2在标准状况下的体积为44.8L,假设所需要的O2全由Na2O2所提供,则每小时所需Na2O2的质量为________Kg。
(3)3.1gNa2O溶于水配成1L溶液,溶液中Na+离子物质的量浓度为________
(4)制备Fe(OH)3胶体:用洁净的烧杯取一定量蒸馏水,用酒精灯加热至沸腾,向烧杯中加入几滴饱和FeCl3溶液继续加热至液体呈透明的红褐色。
①写出制备Fe(OH)3胶体反应的离子方程式______________________________
②验证制得的分散系是胶体的方法为_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:Fe3+、Mg2+、SCN﹣、Cl﹣
B.c(H+)=10﹣12 molL﹣1的溶液中:K+、Na+、CO![]() 、NO
、NO![]()
C.c(Fe2+)=1 molL﹣1的溶液中:K+、NH![]() 、MnO
、MnO![]() 、SO
、SO![]()
D.能使甲基橙变红的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B. 一定条件下,2.3 g的Na完全与O2反应生成3.6 g产物,失去的电子数为0.2 NA
C. 钠与水反应:2Na+2H2O=2Na++2OH-+H2↑
D. 金属钠着火时使用泡沫灭火器灭火
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2L 由 NaCl、MgCl2、CaCl2 组成的混合液中,部分离子浓度大小如图所示,则此溶液中Ca2+离子的物质的量是

A.3.0molB.2.0molC.1.0molD.0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置设计正确且能达到实验目的的是
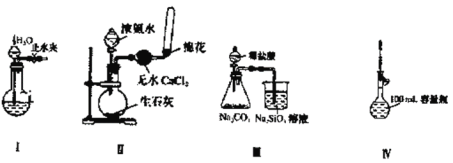
A.实验装置Ⅰ:检查装置的气密性
B.实验装置Ⅱ:制取收集氨气
C.实验装置Ⅲ:比较氯、碳、硅三种元素的非金属性强弱
D.实验装置Ⅳ:定容
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素包括氟、氯、溴、碘、砹等元素,位于元素周期表中第ⅦA族。
(1)画出下列卤族元素的原子结构示意图:①氟________;②氯________③溴________;④碘_________。
(2)比较卤族元素的原子结构:
①它们在结构上的相同点是____________;
②它们在结构上的不同点是_____________。
(3)卤族元素原子结构的变化规律是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.12 g铁粉加入到25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉剩余,溶液呈浅绿色,Cl-基本不变
B.向溶液中滴入无色硫氰化钾溶液,仍无色
C.溶液中Fe2+与Fe3+物质的量之比为6∶1
D.氧化产物与还原产物的物质的量之比为2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期元素构成的三种粒子:甲a(单核带一个单位正电荷)、乙I(四核不带电荷)、丙e(双核带一个单位负电荷),它们都有10个电子。物质A由甲、丙构成,B、C、D、K都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示:
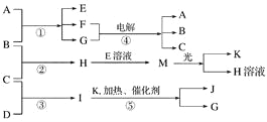
请填写下列空白:
(1)写出下列物质的化学式:B________,I________,J________。
(2) A的化学式是__________________。
(3)写出下列反应的离子方程式:
①H+E(溶液)→M_________________________________________________________。
②I溶于G________________________________________________________________。
(4)写出反应①的化学方程式_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com