
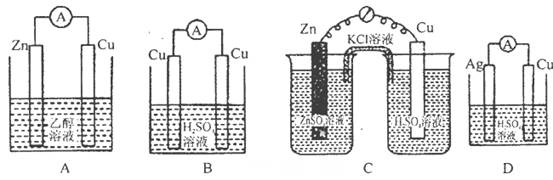
科目:高中化学 来源:不详 题型:单选题
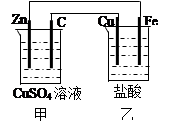
| | 甲池 | 乙池 |
| A | Zn极:Zn-2e-= Zn2+ | Cu极:Cu-2e-= Cu2+ |
| B | Cu2+移向C电极 | Cl-移向Fe电极 |
| C | 每消耗1molZn | 生成1mol气体 |
| D | C极的质量增加ag | Cu极的质量减小ag |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原电池放电时,负极上发生反应的物质是Zn |
| B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2 |
| C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
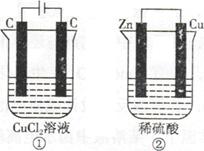
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上生成物质的质量:①=② |
| D.电极反应式:①中阳极2Cl—-2e—=Cl2↑,②中负极2H++2e—=H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )
的酸性废水,最终使铬元素以Cr(OH)3沉淀的形式除去。某科研小组用该原理处理污水,设计装置如图所示。下列说法一定不正确的是( )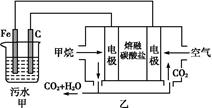
| A.燃料电池中若有1.6 g CH4参加反应,则甲中C电极理论上生成气体体积为8.96 L |
| B.实验时若污水中离子浓度较小,导电能力较差,可加入适量的Na2SO4 |
C.该燃料电池正极的电极反应式为:O2+4e-+2CO2=2C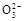 |
D.甲中阳极附近溶液中的离子反应方程式是:Cr2 +6Fe2++14H+=2Cr3++6Fe3++7H2O +6Fe2++14H+=2Cr3++6Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.X电极是负极,电极反应式为CH4-8e-+4CO32-=5CO2+2H2O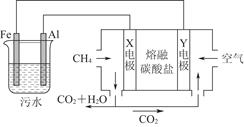 |
| B.铁作阳极,失去电子生成Fe2+ |
| C.工作时熔融盐中的碳酸根移向Y电极 |
| D.污水中存在反应4Fe2++10H2O+O2=4Fe(OH)3↓+8H+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )
Sn2+ (aq)+Pb(s) △H<0,设计成如下图所示的原电池,一段时间后,灵敏电流计读数为零。则下列判断不正确的是( )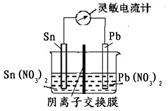
| A.此时化学反应达到平衡状态 |
| B.若此时将Sn电极换成质量较大的Sn 电极后,电流计指针偏转,c(Pb2+)将减小 |
| C.若此时向左池加入少量的Sn(NO3)2固体,电流计指针偏转,Sn电极为正极 |
| D.若此时升高温度,c(Sn2+)将减小,Pb电极为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com