
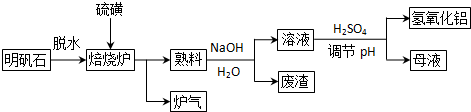
| ||
| ||
| V |
| Vm |
| 3 |
| 2 |
| 1.12L |
| 22.4L/mol |


 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
| A、1molO的质量是16g/mol |
| B、2g H2的物质的量是 1 |
| C、CO2的相对分子质量为44,1 molCO2的质量为44 g/mol |
| D、NaCl的摩尔质量是58.5g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
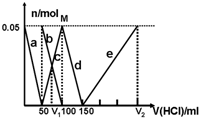 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol?L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法不正确的是( )| A、M点时生成的CO2为0 mol |
| B、V1:V2=1:4 |
| C、原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 |
| D、a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
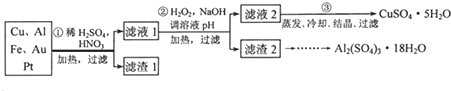
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 2.2 | 3.2 |
| Al3+ | 3.7 | 4.7 |
| Cu 2+ | 5.6 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2和CO的混合物 |
| B、CH2O2 |
| C、HCHO |
| D、CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com