
【题目】下列各组中的物质,均能发生加成反应的是
A. 溴苯和植物油 B. 苯和环已烷
C. 乙烯和乙烷 D. 乙醇和乙酸
科目:高中化学 来源: 题型:
【题目】下图是不完整的元素周期表。A~H八种元素的位置已确定,完成下列各题。
A | |||||||||||||||||
B | C | D | |||||||||||||||
E | F | G | |||||||||||||||
H | |||||||||||||||||
(1)用实线画出元素周期表的上边界。用阴影表示出非金属元素。(请用黑色水笔书写)__________
(2)用一个置换反应证明F和G的非金属性强弱:(书写离子方程式)_____________。
(3)已知A和C能形成含有18个电子的化合物,其含有的化学键的类型为__________、__________。
(4)已知A和C也能形成CA5的离子化合物,请书写其电子式__________________。
(5)H能与C的最高价氧化物对应的水化物的稀溶液反应,写出反应的离子方程式________________。
(6)判断B的氢化物和E的氢化物的沸点高低:BHm_____________EHm(填“大于”、“等于”或“小于”)。
(7)C的氢化物极易溶于D的氢化物的原因是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入400mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A. 4.0mol/L B. 3.2mol/L
C. 2.0mol/L D. 1.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。
|
|
|
|
A | B | C | D |
(1)为验证上述气体,将混合气体依次通过所用仪器,其顺序为:混合气体→_____→ A →_____→_____(每种仪器只能使用一次)
(2)A中品红溶液的作用是__________________________。
(3)确定有CO2生成的实验现象是____________________________________________。
(4)在不影响实验检验结果的情况下,理论上B中的高锰酸钾溶液还可以用下列哪些试剂代替_____________
①饱和NaHCO3溶液 ②浓硫酸 ③氯水 ④H2S溶液 ⑤Na2SO3溶液
Ⅱ.实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。
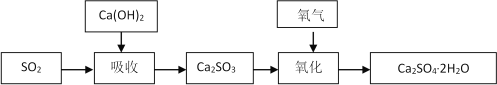
石灰-石膏法的吸收反应为SO2+Ca(OH)2=CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O=2CaSO4·2H2O。其流程如下图:
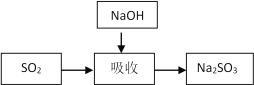
碱法的吸收反应为SO2+2NaOH=Na2SO3+H2O。碱法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如下图:
已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收SO2的成本(元/mol) | 0.027 | 0.232 |
(1)石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是 ____________________ 。和碱法相比,石灰-石膏法的优点是 ________________ ,缺点是 ________________ 。
(2)某学习小组在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是__________________、___________________、___________________(填化学式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近些年,半导体材料在电子领域发展迅速,科学家一般在分界线出寻找半导体材料,如硅、锗、砷及GaAs等化合物。回答下列问题:
(1)基态As原子的外围电子排布式为________,原子核外有______个未成对电子。
(2)实验测得镓的氯化物的熔沸点显著低于其对应化合价的氯化物,其原因可能是_________。
(3)Ge、Se、As位于周期表第四周期,其第一电离能由大到小的顺序为______。
(4)AsH3分子的立体构型为 ______,其中As的杂化轨道类型为______。
(5)碳和硅属于同主族元素,碳能形成多种氢化物,但硅的氢化物很少且不稳定,试从原子结构角度分析可能的原因__________。
(6)GaAs晶胞结构如图所示,若A的坐标参数为(0,0,0),B为(0,1/2,1/2)、C为(1,0,0)、则D的坐标参数为_______。已知GaAs的晶胞边长为apm,其密度为_____ g·cm-3(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示装置制备氯气并进行一系列相关的实验(加热装置和夹持设备已省略).
![]()
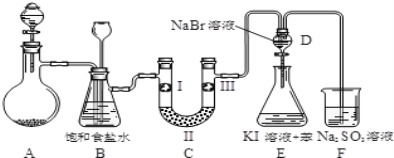
(1)A中盛装液体仪器的名称是:______.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是______;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:____________.
(3)制备氯气选用的药品为:MnO2和浓盐酸,写出制备氯气的化学反应方程式___________________.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、Ⅱ、Ⅲ依次放入(填符号)______.
a | b | c | d | |
I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯___溴(填“>”或“<”).
(6)反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_________________,根据上述现象(“能”、“不能”)___说明非金属性溴强于碘。
(7)F处为尾气吸收装置,写出其离子反应方程式__________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的关系正确的是
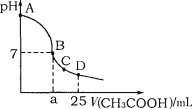
A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)+c(OH-)>c(H+)+c(Na+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | ||
A | 25 | 5 | 0.1 | 20 | 0.1 |
B | 25 | 5 | 0.2 | 10 | 0.2 |
C | 35 | 5 | 0.1 | 20 | 0.1 |
D | 35 | 5 | 0.2 | 10 | 0.2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com