
【题目】取一定质量的Cu2O和CuO混合粉末,将其均匀混合后分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g,另一份中加入400mL稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
A. 4.0mol/L B. 3.2mol/L
C. 2.0mol/L D. 1.6mol/L
【答案】A
【解析】将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,其中一份用足量的氢气还原,反应后固体质量减少6.40g为拆分后Cu、CuO的混合物中O元素的质量,O原子的物质的量为![]() =0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为
=0.4mol,根据Cu元素守恒可知n(CuO)=n(O)=0.4mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2,且同时收集到标准状况下NO气体4.48L,NO的物质的量为![]() =0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为
=0.2mol,根据电子转移守恒可知拆分后Cu、CuO的混合物中2n(Cu)=3n(NO)=3×0.2mol,n(Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,根据氮元素守恒可知n(HNO3)=n(NO)+2n[Cu(NO3)2]=0.2mol+2×0.7mol=1.6mol,硝酸的浓度为![]() =4.0mol/L,故选A。
=4.0mol/L,故选A。


科目:高中化学 来源: 题型:
【题目】向1mol炽热的Cu2S通入足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为
A. CuO和SO2 B. Cu和S C. Cu和SO2 D. Cu2O和S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素分别位于三个周期,它们的原子序数依次增大。A与D同主族,B与E同主族,C与F同主族,且C与F能形成原子个数比为2∶1的化合物M与原子个数比为3∶1的化合物N。已知F的单质为淡黄色固体,E元素在地壳中含量居第2位,D为金属。
(1)写出下列元素符号:A________,B________,E__________。
(2)少量M与D的最高价氧化物水化物反应的化学方程式____________________________。
(3)写出F在元素周期表中的位置________________。
(4)写出A、C、D形成的化合物的电子式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列两种溶液中,室温下由水电离生成的H+浓度之比(①∶②)是 。
①pH=1的盐酸 ②0.01 mol·L-1的NaOH溶液
II.已知水在25℃和95℃时,其电离平衡曲线如图所示:
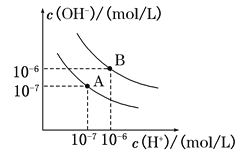
(1)则25℃时水的电离平衡曲线应为 (填“A”或“B”);95℃时水的离子积KW= 。
(2)25℃时,将pH=9的Ba(OH)2溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则Ba(OH)2溶液与H2SO4溶液的体积比为 。
(3)曲线A对应温度下,pH=2的盐酸溶液和pH=11的氢氧化钠溶液按体积比1:9混合,溶液的pH约为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①pH=2和pH=1的HNO3中c(H+)之比为1∶10
②0.2 mol/L与0.1 mol/L醋酸中,c(H+)之比大于2∶1
③Na2CO3溶液中c(Na+)与c(CO![]() )之比为2∶1
)之比为2∶1
④纯水在100℃和20℃时,pH前者大
⑤同温时,pH=10的KOH溶液和pH=10的KCN溶液中由水电离的OH-浓度后者大
⑥100 mL 0.1 mol/L的醋酸溶液与10 mL 1.0 mol/L的醋酸溶液中H+的数目,前者多
A.①④⑤ B.①⑤⑥ C.①②⑤ D.①②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着广泛的应用,下列对立关系正确的是
选项 | 化学性质 | 实际应用 |
A | SO2具有还原性 | 漂白纸浆 |
B | HF具有弱酸性 | 在玻璃上刻字, |
C | 铝的金属活动性强于氢 | 用铝制容器贮运浓硝酸 |
D | FeCl3溶液能与Cu反应 | 蚀刻铜箔制造电路板 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ① | |||||||
二 | ② | ③ | ④ | |||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在标号元素中,最活泼的金属元素是____。最活泼的非金属元素是____。(写元素符号)⑨元素的离子结构示意图是____________________。
(2)①与②形成共价化合物的电子式________________。用电子式表示⑤与⑨形成化合物的形成过程__________________________________________。
(3)⑤、⑥、⑦三种元素的原子半径由大到小的顺序是________。(写元素符号)
(4)⑦、⑧、⑨三种元素所形成的气态氢化物中,最稳定的氢化物是____(写分子式);其三种元素的最高价含氧酸的酸性由强到弱的顺序 _________。(写酸的分子式)
(5)写出⑥元素的单质与氢氧化钠反应的离子方程式:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com