
【题目】海水结冰形成海冰,海冰中部分盐分被包裹在冰晶中,形成如下图所示的含“盐泡”(设1个盐泡中含1个NaCl单元)的海冰。测得某海冰内层中NaCl的浓度为10-4mol·L-1,已知该层海冰的密度为0.9g·cm-3。下列说法错误的是( )
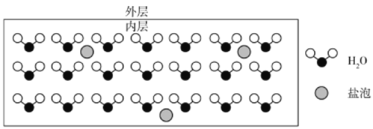
A.“盐泡”内的钠、氯以离子的形式存在
B.海冰密度越大,则海冰中的“盐泡”越少
C.海冰中形成的氢键比例比海水中的大
D.该海冰中“盐泡”与H2O的个数比约为1:(5105)
科目:高中化学 来源: 题型:
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
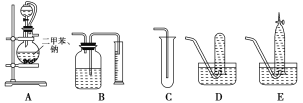
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产医用防护口罩的原料聚丙烯纤维属于有机高分子材料,其单体为丙烯。丙烯除了合成聚丙烯外,还广泛用于制备1,2—二氯丙烷、丙烯醛、丙烯酸等。请回答下列问题:
Ⅰ.工业上用丙烯加成法制备1,2—二氯丙烷,主要副产物为3—氯丙烯,反应原理为:
①![]()
![]()
②![]()
![]()
(1)已知![]() 的活化能
的活化能![]() (逆)为
(逆)为![]() ,则该反应的
,则该反应的![]() (正)活化能为_____
(正)活化能为_____![]() 。
。
(2)一定温度下,向恒容密闭容器中充入等物质的量的![]() 和
和![]() ,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
,在催化剂作用下发生反应①②,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
用单位时间内气体分压的变化来表示反应速率,即![]() ,则反应①前180min内平均反应速率
,则反应①前180min内平均反应速率![]() ____
____![]() (保留小数点后2位)。
(保留小数点后2位)。
Ⅱ.丙烯的制备方法
方法一:丙烷无氧脱氢法制备丙烯反应如下:
![]()
![]()
(3)①某温度下,在刚性容器中充入![]() ,起始压强为10kPa,平衡时总压为14kPa,
,起始压强为10kPa,平衡时总压为14kPa,![]() 的平衡转化率为______。该反应的平衡常数
的平衡转化率为______。该反应的平衡常数![]() ______kPa(保留小数点后2位)。
______kPa(保留小数点后2位)。
②总压分别为100kPa、10kPa时发生该反应,平衡体系中![]() 和
和![]() 的物质的量分数随温度变化关系如图所示:
的物质的量分数随温度变化关系如图所示:
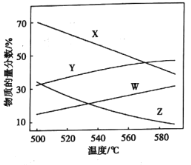
10kPa时,![]() 和
和![]() 的物质的量分数随温度变化关系的曲线分别是_____、______。
的物质的量分数随温度变化关系的曲线分别是_____、______。
方法二:丙烷氧化脱氢法制备丙烯还生成![]() 、
、![]() 等副产物,制备丙烯的反应如下:
等副产物,制备丙烯的反应如下:
![]()
![]() 。在催化剂作用下
。在催化剂作用下![]() 的转化率和
的转化率和![]() 的产率随温度变化关系如图所示。
的产率随温度变化关系如图所示。
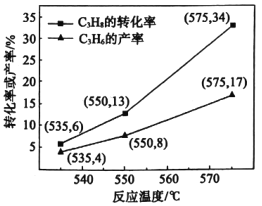
(4)①图中![]() 的转化率随温度升高而上升的原因是_________。
的转化率随温度升高而上升的原因是_________。
②575℃时,![]() 的选择性为___。(
的选择性为___。(![]() 的选择性=
的选择性=![]() )
)
③基于上述研究结果,能提高![]() 选择性的措施是______。
选择性的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的X加入某密闭容器中,发生反应:2X(g)![]() 3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是()。
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:下列推断正确的是()。
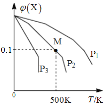
A. 升高温度,该反应平衡常数K减小
B. 压强大小有P3>P2>P1
C. 平衡后加入高效催化剂使平均摩尔质量增大
D. 在该条件下M点X平衡转化率为9/11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 。室温下,向浓度为0.1mol·L-1的氨水中缓缓通入HCl,
。室温下,向浓度为0.1mol·L-1的氨水中缓缓通入HCl,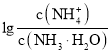 随pOH的变化曲线如下图所示。假设溶液体积没有变化,下列推断正确的是( )
随pOH的变化曲线如下图所示。假设溶液体积没有变化,下列推断正确的是( )
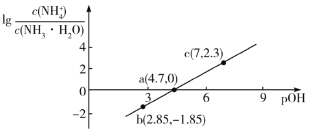
A.NH3·H2O的电离常数的数量级为10-4
B.b点溶液中:![]()
C.c点溶液中:![]()
D.pOH=8的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将体积均为5 mL的甲、乙、丙三种液体依次沿试管壁缓缓滴入试管中(勿振荡),出现如图所示的实验现象,则甲、乙、丙的组合可能是( )
![]()
选项 | A | B | C | D |
甲 | 1,2二溴乙烷 | 溴苯 | 水 | 乙醇 |
乙 | 水 | 液溴 | 大豆油 | 乙酸 |
丙 | 苯 | 乙醇 | 溴水 | 乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙是一种重要的溴化物,可用于制造光敏纸、灭火剂、制冷剂等,以石灰乳、液溴及氨等为原料制备CaBr22H2O的实验流程如下:
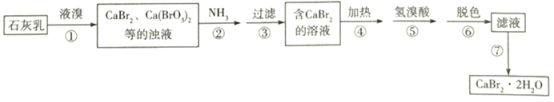
(1)步骤①需控制在70℃以下,温度不宜过高的原因是________________。
(2)下列实验室制取少量NH3的方法正确的是_____________(填标号)。
A. B.
B. C.
C.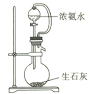 D.
D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为_______________________。
(4)步骤④、⑤的目的依次是_______________________________、________________________。
(5)步骤⑥常用_________________进行脱色,它利用了该物质的____________________。
(6)步骤⑦得到产品的操作方法是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,下列热化学方程式书写正确的是()
A. CH3OH(l)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D. 2CH3OH(l)+3O2(g)![]() 2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
2CO2(g)+4H2O(l)ΔH=+1451.52 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com